
O mundo está repleto de matéria. Basta um olhar rápido ao nosso redor para perceber que elementos naturais como a água, o ar e as rochas, assim como elementos artificiais como o plástico e o vinil, são todos feitos de matéria. Mas o que acontece se continuarmos dividindo a matéria em partes cada vez menores? Se a dividirmos até o ponto em que não pode mais ser dividida, chegamos ao átomo que é a unidade básica da matéria.
O elemento é uma substância pura composta por um único tipo de átomo e é considerado o componente básico que constitui todas as coisas. Cerca de 110 elementos já foram descobertos, e aproximadamente 90 deles são encontrados na natureza. Além disso, apenas cerca de 40 são comumente encontrados.
O mistério da ligação química
Em um parque temático, há uma vila feita com pequenos blocos coloridos. É impressionante ver que grandes construções consideradas pontos turísticos, além de carros e até balanços no parquinho, podem ser feitos apenas empilhando blocos. Da mesma forma, a maioria das substâncias que existem ao nosso redor também é formada por compostos resultantes da combinação de dois ou mais elementos. Assim como diferentes tipos de blocos são empilhados para formar diversas formas, os átomos se combinam para formar diversos compostos.
Curiosamente, as propriedades dos compostos diferem significativamente das dos elementos que os compõem. A molécula de água (H₂O) é um composto formado pela união de dois átomos de hidrogênio e um átomo de oxigênio. O hidrogênio (H₂), que normalmente aparece como uma molécula formada por dois átomos, é um gás altamente inflamável e se incendeia com facilidade ao entrar em contato com o ar. O oxigênio (O₂), que também é uma molécula diatômica como o hidrogênio, é altamente reativo e se combina diretamente com quase todos os elementos. Já a água, formada pela ligação desses dois elementos, é normalmente encontrada no estado líquido e é muito estável. Em vez de causar combustão como o oxigênio, ou queimar por conta própria como o hidrogênio, ela é utilizada para apagar o fogo.
Uma substância completamente diferente pode ser formada a partir dos mesmos tipos de átomos. Quando dois átomos de hidrogênio e dois de oxigênio se unem, formam o peróxido de hidrogênio (H₂O₂), que é usado como desinfetante. Diferente da água, o peróxido de hidrogênio é extremamente instável e se decompõe facilmente em água e oxigênio em temperatura ambiente.
Assim como é possível criar diversas coisas usando blocos do mesmo formato e tamanho, diferentes substâncias podem ser formadas mesmo a partir de um único tipo de elemento. Entre esses elementos, o carbono se destaca. Tanto o diamante quanto o grafite são formados apenas por átomos de carbono, mas possuem propriedades completamente diferentes devido às diferentes formas de ligação entre esses átomos.
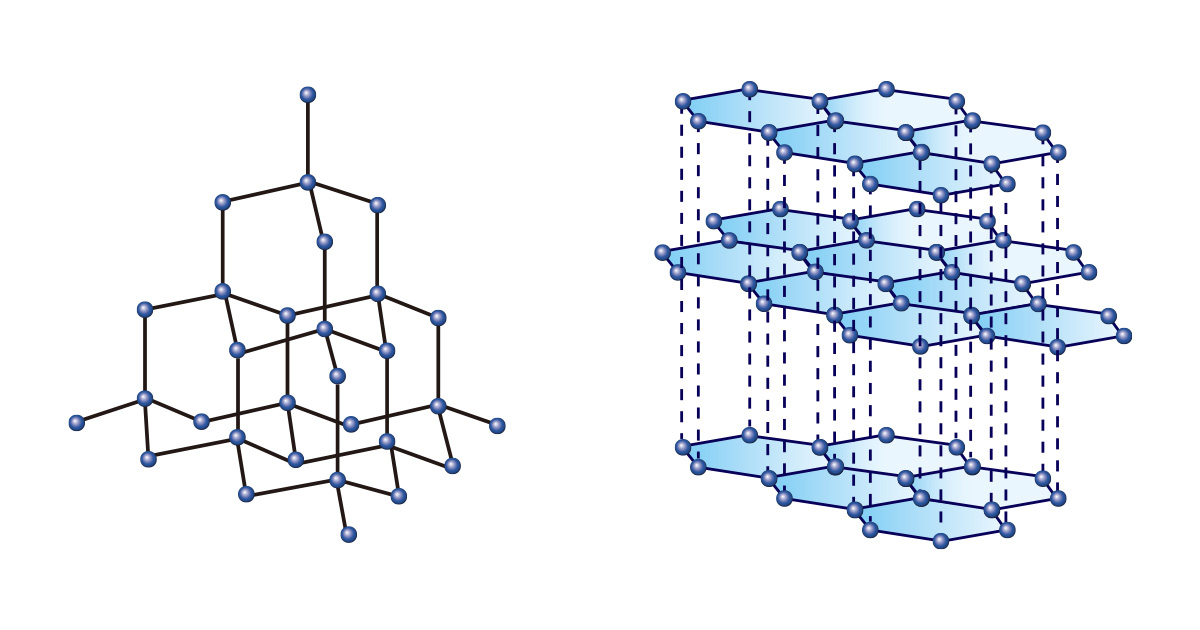
Os diamantes, nos quais os átomos de carbono estão ligados continuamente formando uma estrutura tetraédrica, são tão duros que não apenas são considerados gemas que simbolizam a eternidade, como também são usados para cortar ou polir materiais na indústria. Por outro lado, o grafite, que possui camadas empilhadas de estruturas hexagonais bidimensionais, é utilizado como grafite de lápis por ser macio e fácil de riscar.

Regras para a formação de compostos
Existem certas regras que determinam como os átomos formam compostos. Dentro do átomo, há um núcleo com carga positiva, e elétrons com carga negativa giram ao seu redor. O núcleo do átomo contém prótons e nêutrons. Como o número de prótons e elétrons em um átomo é igual, o átomo, por si só, é eletricamente neutro.
Os cientistas presumem que os elétrons se organizam em camadas ao redor do núcleo atômico de acordo com seu nível de energia, como uma forma de simplificar a distinção entre os diferentes estados de energia que os elétrons podem ocupar. A camada formada pelos elétrons é chamada de “camada eletrônica”, e cada uma possui um número máximo definido de elétrons: 2 elétrons na primeira camada, 8 na segunda e 18 na terceira.
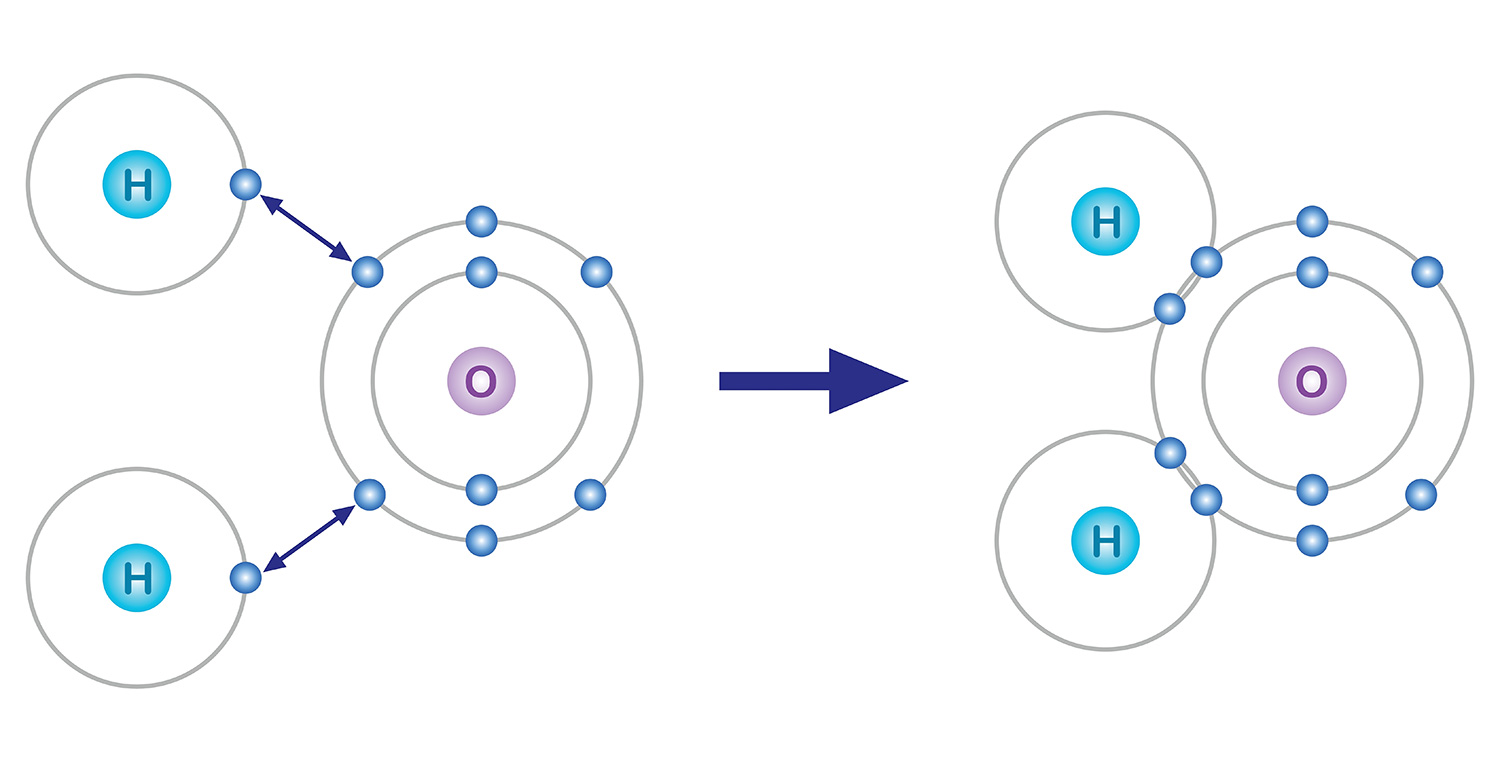
Entre esses elétrons, os que estão na camada mais externa são os que participam das ligações químicas. Os átomos tendem a completar oito elétrons na última camada, mesmo que precisem perder ou ganhar elétrons para isso, e essa tendência é chamada de “regra do octeto”. Por exemplo, o oxigênio, que possui 8 elétrons, contém 2 elétrons na primeira camada e 6 na segunda. Assim, para que a última camada atinja 8 elétrons, o oxigênio realiza ligações químicas para obter mais 2 elétrons.
Diversas ligações químicas
Existem diversas formas pelas quais um átomo pode se combinar com outros. Uma dessas formas é a chamada “ligação covalente”. Nessa ligação, os átomos compartilham seus elétrons como se estivessem dando as mãos, utilizando uma estratégia de ganha-ganha para satisfazer a regra do octeto. As partículas formadas pela combinação de átomos por meio desse tipo de ligação são chamadas de “moléculas”.
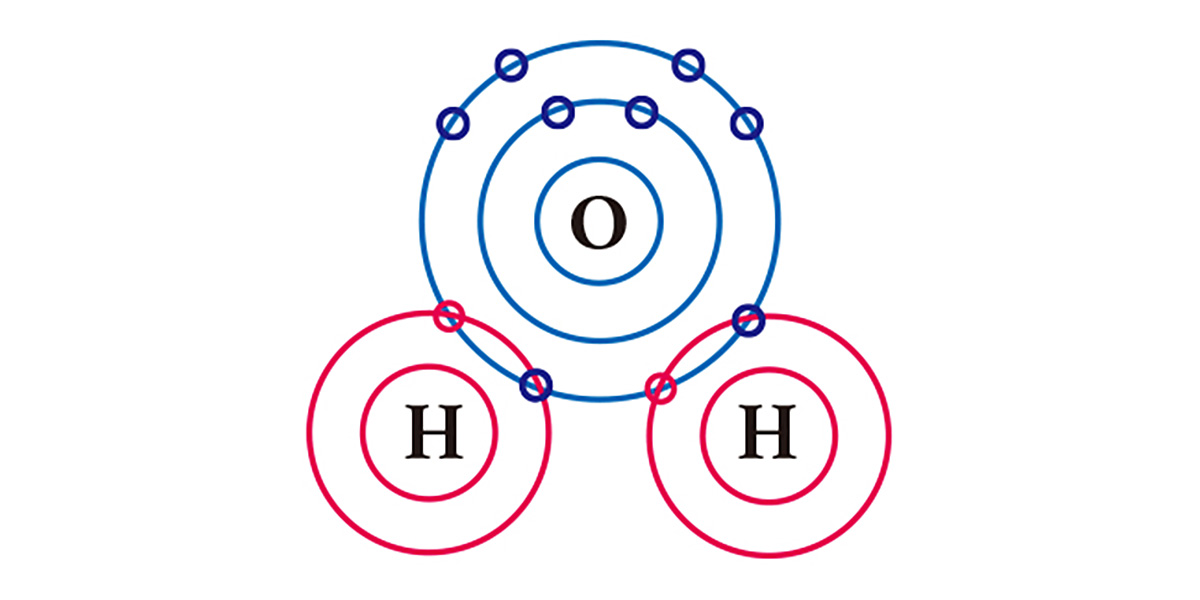
Tomemos a água como exemplo. Um átomo de oxigênio, que possui 6 elétrons em sua camada mais externa, precisa de 2 elétrons para se completar, enquanto um átomo de hidrogênio, que tem apenas 1 elétron, precisa de mais 1. Para se estabilizarem, o átomo de oxigênio compartilha os elétrons de dois átomos de hidrogênio por meio de ligações covalentes, formando uma molécula. Ao compartilharem um elétron cada, tanto o oxigênio quanto os hidrogênios passam a ter, na prática, dois elétrons em sua camada externa, atingindo a estabilidade.
No caso do dióxido de carbono (CO₂), o átomo de carbono, que precisa de quatro elétrons para se estabilizar, se combina com dois átomos de oxigênio para obter esses quatro elétrons (dois de cada oxigênio). A ligação entre o carbono e o oxigênio é muito mais forte do que a ligação entre o oxigênio e o hidrogênio na molécula de água. Assim como segurar duas mãos proporcionam uma conexão mais firme do que segurar apenas uma, quanto maior o número de elétrons compartilhados, mais forte é a ligação.
Entre os elementos, há aqueles que gostam de “dar generosamente”. Metais como o sódio, o alumínio e o ferro cumprem a regra do octeto liberando facilmente seus elétrons excedentes. Por outro lado, não metais como o oxigênio, o nitrogênio e o cloro preferem receber elétrons em vez de doá-los. A ligação entre eles é chamada de “ligação iônica”, que é uma ligação eletrostática em que o metal perde elétrons e se torna um cátion (íons com carga positiva), enquanto o não metal recebe esses elétrons e se torna um ânion (íons com carga negativa).
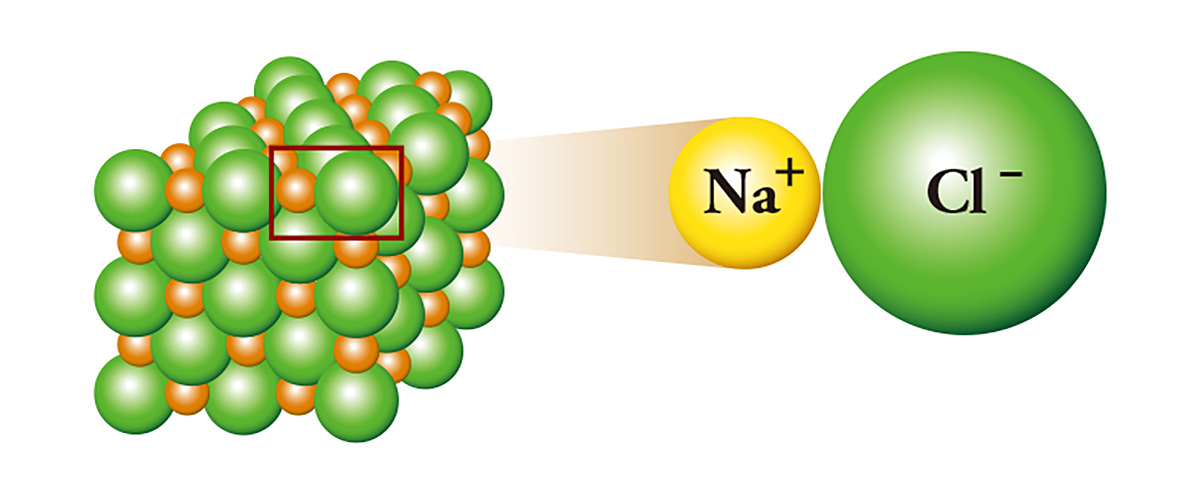
O cloreto de sódio (NaCl), comumente conhecido como sal, é um exemplo clássico de ligação iônica. O sódio, que possui um elétron excedente, se liga ao cloro ao doar esse elétron, que é justamente o que o cloro precisa. O sódio, ao doar o elétron, torna-se um cátion, enquanto o cloro, ao recebê-lo, torna-se um ânion. Como resultado, ocorre uma atração elétrica entre os dois íons, e eles se unem como os polos norte e sul de um ímã, formando cristais. O sódio, um metal tão reativo que precisa ser armazenado em óleo mineral ou querosene, e o cloro, uma substância tóxica usada como gás venenoso, se encontram e formam o sal.
A ligação metálica, observada em metais sólidos formados por um único tipo de átomo, como o ouro ou o alumínio, ocorre quando os átomos metálicos liberam seus elétrons mais externos, que estão fracamente ligados ao núcleo, tornando-se cátions organizados em uma estrutura ordenada. Os elétrons liberados se movimentam livremente entre os cátions, mantendo a ligação. Esses elétrons deslocalizados se movimentam livremente entre os cátions e mantêm a ligação.
Os átomos se ligam por meio do compartilhamento ou da troca de elétrons. Às vezes, substâncias perigosas se unem para formar um composto mais estável do que qualquer outro, e, dependendo da forma como se combinam, podem se tornar mais fracos ou mais fortes. No mundo das partículas, os átomos se combinam entre si e dão origem a matérias completamente diferentes.
A maior parte da matéria é composta por apenas cerca de 20 elementos. No entanto, quando esses poucos elementos se combinam, podem formar uma enorme variedade de compostos. Segundo o Chemical Abstract Service (CAS), existem mais de 140 milhões de substâncias químicas na Terra, e mais de 10 mil novos compostos são registrados todos os dias (dados de abril de 2018). Considerando que ainda há muitos compostos não descobertos, esse número é ainda maior. O mistério do micromundo, que dá origem a uma variedade incontável de compostos, é realmente fascinante.