
El mundo está lleno de materia. Un vistazo rápido a nuestro alrededor es suficiente para ver que las cosas naturales como el agua, el aire y las rocas, así como los objetos artificiales como el plástico y el vinilo, están hechos de materia. ¿Qué sucederá si seguimos dividiendo la materia en pedazos más pequeños? Si la divide hasta el punto en que ya no se puede dividir, esto se llama átomo, la unidad básica de la materia.
Una sustancia pura de un tipo de átomo se denomina elemento, el cual es la base de todas las cosas. Se han descubierto unos 110 elementos, y solo aproximadamente 90 de ellos se encuentran en la naturaleza. Además, los que se pueden encontrar comúnmente son solo unos 40.
El misterio del enlace químico
En un parque temático, hay un pueblo que se hizo con pequeños bloques de colores. Es sorprendente que los grandes edificios que se consideran puntos de referencia, y los automóviles, e incluso los columpios en el patio de recreo se puedan crear apilando bloques. Del mismo modo, la mayoría de las sustancias que nos rodean son compuestos resultantes de la combinación de dos o más elementos. Así como se apilan varios tipos de bloques para formar diversas formas, los átomos se combinan para formar diversos compuestos.
Curiosamente, las propiedades de los compuestos difieren significativamente de las de sus elementos constituyentes. La molécula del agua (H₂O) es un compuesto en el que dos átomos de hidrógeno y un átomo de oxígeno se encuentran y se unen. El hidrógeno (H₂), que se encuentra principalmente en forma de molécula al unir dos átomos, es un gas que es fácil de quemar y se enciende fácilmente cuando está en contacto con el aire. El oxígeno (O₂), que es una molécula diatómica como el hidrógeno, es altamente reactivo, y por ello se combina con casi todos los elementos. El agua, que se forma al unir estas dos sustancias, normalmente está en estado líquido y es muy estable. Y se utiliza para extinguir el fuego en lugar de quemar otros materiales como el oxígeno, o quemarse por sí solo como el hidrógeno.
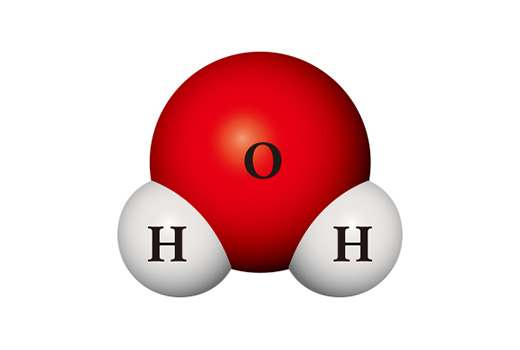
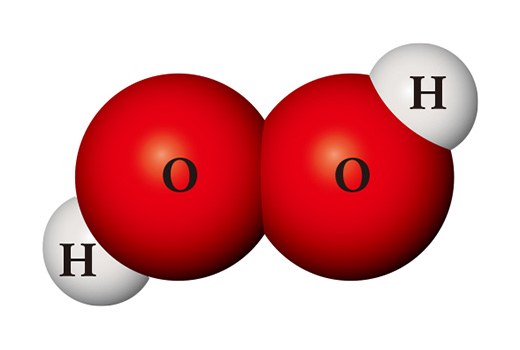
Una sustancia completamente diferente se puede crear a partir de los mismos tipos de átomos. Cuando dos átomos de hidrógeno y dos átomos de oxígeno se encuentran, se convierten en peróxido de hidrógeno (H₂O₂), que se usa como desinfectante. El peróxido de hidrógeno es tan inestable, a diferencia del agua, que se descompone fácilmente en agua y oxígeno a temperatura ambiente.
Así como puede hacer varias cosas usando bloques de la misma forma y tamaño, pueden formarse diversas sustancias hasta con un solo tipo de elemento. Entre ellos, el carbono es único. Tanto el diamante como el grafito están hechos solo de carbono, pero tienen propiedades totalmente diferentes debido a las diferentes disposiciones de unión.
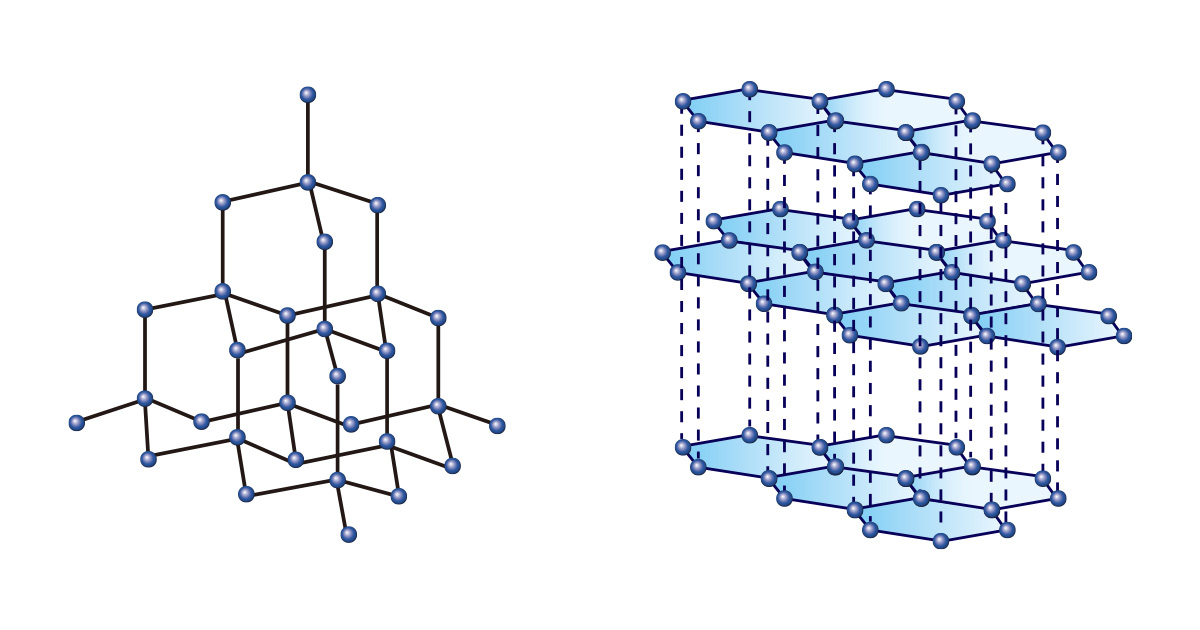
Los diamantes, en los que los átomos de carbono se unen continuamente formando una estructura de tetraedro regular, son tan duros que no solo se consideran gemas que representan la eternidad, sino que también se usan para cortar o pulir materiales en el campo industrial. Por otro lado, el grafito en forma de capas apiladas de estructuras bidimensionales de hexágono regular se usa como punta de lápiz porque es suave y conveniente para dibujar.

Reglas para hacer compuestos
Hay ciertas reglas en las cuales los átomos se unen y forman compuestos. Un átomo está conformado por un núcleo positivamente cargado rodeado de una o más partículas cargadas negativamente llamadas electrones. El núcleo de un átomo contiene protones y neutrones. Dado que el número de protones y electrones contenidos en un átomo es el mismo, el átomo en sí es eléctricamente neutro.
Los científicos suponen que los electrones se disponen en capas alrededor del núcleo atómico de acuerdo con el nivel de energía, con el fin de distinguir simplemente el estado de energía que toman los electrones. La capa formada por electrones se denomina capa electrónica, y hay un número designado de electrones para cada capa: 2 electrones en la primera capa, 8 en la segunda, y 18 en la tercera.
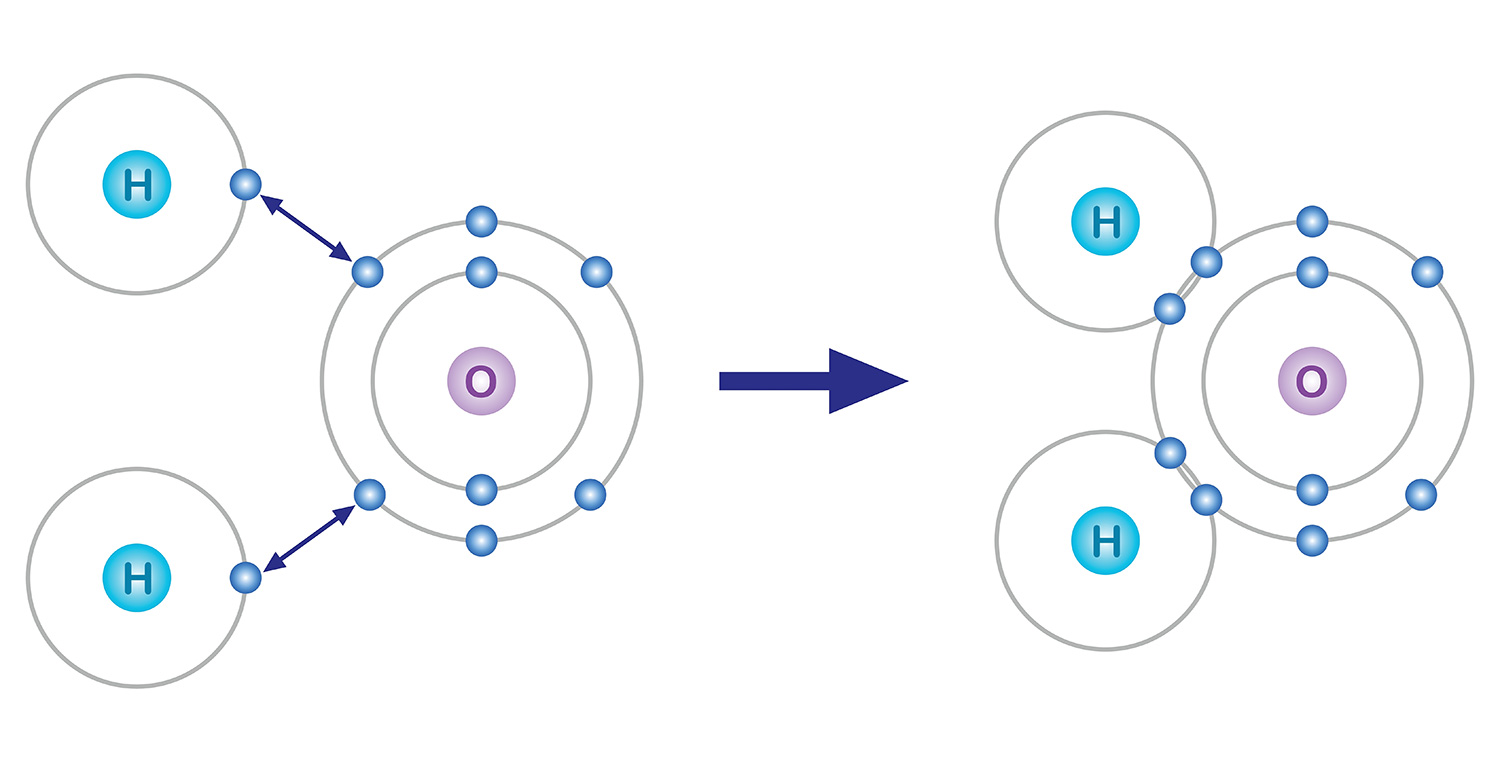
Entre ellos, los electrones en la capa más externa participan en enlaces químicos. Los átomos tienden a tener ocho electrones en la última capa, aunque tengan que perder o ganar electrones para hacerlo, y esto se llama la regla del octeto. Por ejemplo, el oxígeno con ocho electrones contiene dos electrones en la primera capa y seis electrones en la segunda. Por lo tanto, para que la última capa tenga ocho electrones, se realiza un enlace químico para obtener dos electrones más.
Diversos enlaces químicos
Hay muchas maneras en que un átomo se combina con otros átomos. Uno de ellos es el enlace covalente, una estrategia de ganar-ganar donde los átomos satisfacen la regla del octeto al compartir entre sí los electrones como si estuvieran tomados de la mano; las partículas creadas por la combinación de átomos se denominan moléculas.
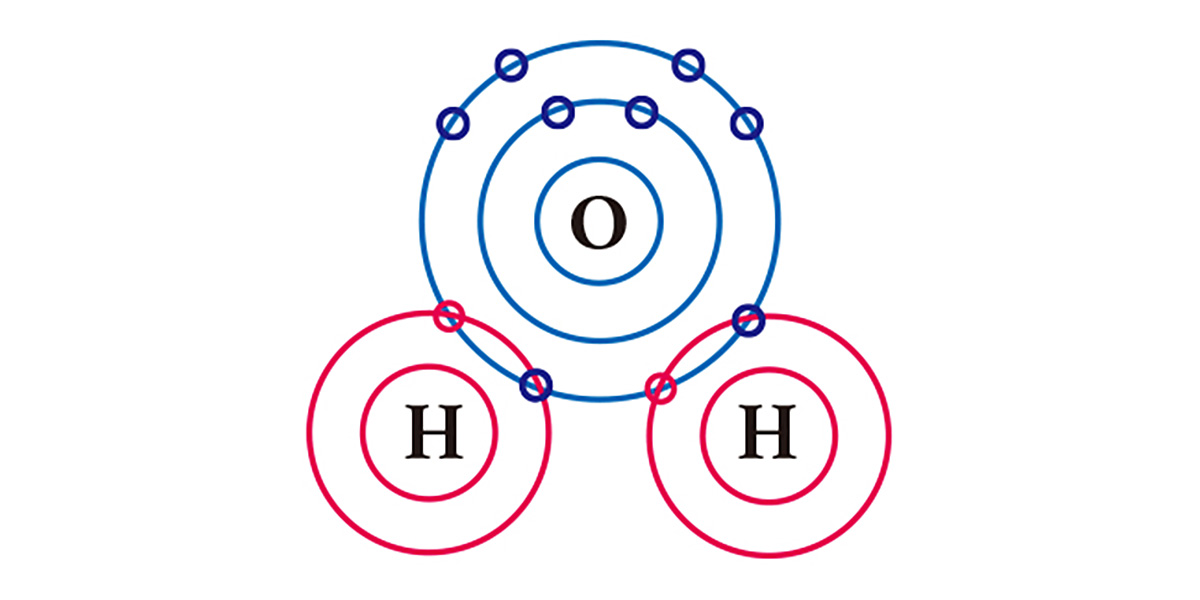
Por ejemplo, tenemos el agua. Un átomo de oxígeno, que tiene seis electrones en su capa de electrones más externa, carece de dos electrones, y un átomo de hidrógeno, que tiene un electrón, carece de uno. Por ello, para estabilizarse, un átomo de oxígeno comparte los dos electrones de los dos átomos de hidrógeno en un enlace covalente, y forman una molécula. Tanto el átomo de oxígeno como los átomos de hidrógeno básicamente obtienen dos electrones cada uno al compartir un electrón cada uno.
En cuanto al dióxido de carbono (CO₂), el átomo de carbono, que requiere cuatro electrones más para estabilizarse, se combina con dos átomos de oxígeno para obtener cuatro electrones (dos de cada uno). El enlace entre el carbono y el oxígeno es mucho más fuerte que el enlace entre el oxígeno y el hidrógeno en la molécula de agua. Así como dos manos que se sostienen son más fuertes que una mano, ya que la cantidad de electrones que comparten es mayor, su enlace es más fuerte.
Entre los elementos, hay algunos a los que les gusta dar generosamente. Los metales como el sodio, el aluminio y el hierro cumplen la regla del octeto y liberan fácilmente sus electrones restantes. Por el contrario, los no metales como el oxígeno, el nitrógeno y el cloro prefieren recibir electrones en lugar de darlos. El enlace entre ellos se llama enlace iónico, que es un enlace electrostático en el que el metal pierde electrones para convertirse en un catión, mientras que el no metal acepta esos electrones para convertirse en un anión.
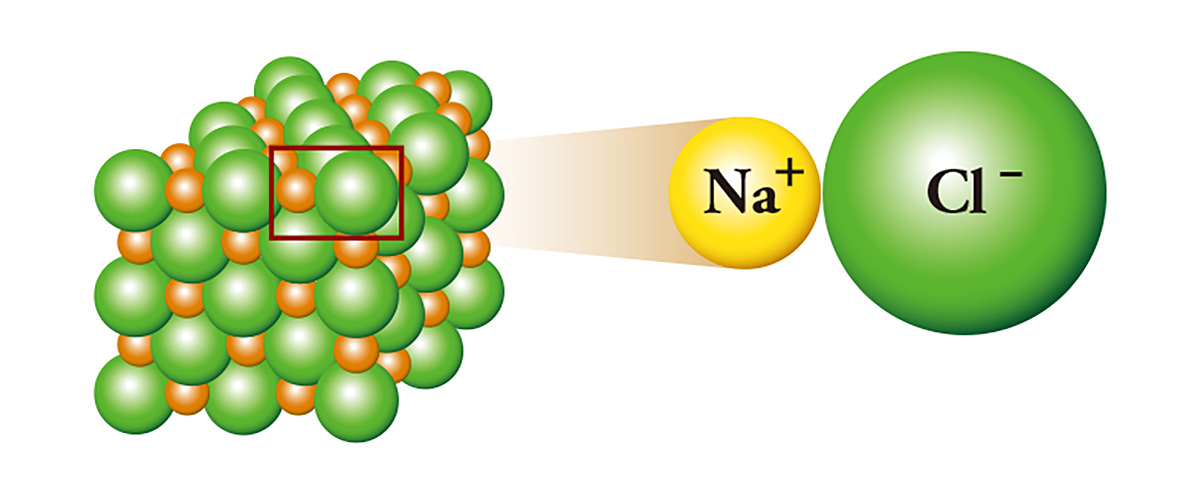
El cloruro de sodio (NaCl), comúnmente conocido como sal, es un representante de la unión de iones. El sodio, que tiene un electrón adicional, se une con el cloro, que carece de un electrón, al darle el electrón. El sodio, que da el electrón, se convierte en catión, y el cloro, que recibe el electrón, se convierte en anión. Como resultado, se produce una atracción eléctrica entre los dos iones y se adhieren entre sí como el polo norte y el polo sur de un imán, y amontonándose forman cristales. El sodio, un metal que tiene que almacenarse en aceite mineral o queroseno por ser altamente reactivo, y el cloro, una sustancia tan tóxica que se usa como gas venenoso, se juntan y se convierten en sal.
Los enlaces metálicos se pueden ver en metales sólidos compuestos de un tipo de átomo, como el oro o el aluminio. Es un tipo de enlace químico formado entre átomos cargados positivamente en el que los electrones libres se comparten en una red de cationes. Los electrones deslocalizados se mueven libremente entre los cationes y mantienen el enlace.
Los átomos se unen al compartir o intercambiar electrones. A veces, las sustancias peligrosas se unen para formar un compuesto más estable que cualquier otro compuesto y, dependiendo de cómo se combinen, se hacen más débiles o más fuertes. En el mundo de las partículas, los átomos se combinan entre sí y forman materias completamente diferentes.
La mayoría de la materia está formada por solo unos 20 elementos. Sin embargo, cuando estos pocos elementos se combinan, se crean muchos compuestos diferentes. Según el Chemical Abstract Service (CAS), hay más de 140 millones de productos químicos en la Tierra y más de 10 000 nuevos compuestos se registran todos los días (hasta abril de 2018). Dado que todavía hay muchos que no se han descubierto, la cantidad de productos químicos será aún mayor. El misterio del micromundo, que está creando una innumerable variedad de compuestos, es realmente misterioso.