
Die Welt ist voll von Stoffen. Ein kurzer Blick um uns herum genügt, um zu sehen, dass sowohl natürliche Dinge wie Wasser, Luft und Felsen als auch künstliche Dinge wie Plastik und Vinyl aus Materie bestehen. Was wird passieren, wenn wir die Materie immer weiter in kleinere Teile zerlegen? Wenn man sie bis zu dem Punkt teilt, an dem sie nicht mehr geteilt werden können, spricht man von einem Atom – der Grundeinheit der Materie.
Eine reine Substanz aus einer Art von Atom wird als Element bezeichnet. Es wurden etwa 110 Elemente entdeckt, von denen etwa 90 in der Natur vorkommen. Darüber hinaus gibt es nur etwa 40 Elemente, die in der Natur vorkommen können.
Das Geheimnis der chemischen Bindung
In einem Freizeitpark gibt es ein Dorf, das aus kleinen bunten Blöcken gebaut wurde. Es ist erstaunlich, dass große Gebäude, die als Wahrzeichen gelten, und Autos und sogar Schaukeln auf dem Spielplatz durch das Stapeln von Blöcken entstehen können. Ebenso sind die meisten Stoffe um uns herum Verbindungen aus der Kombination von zwei oder mehr Elementen. Genauso wie verschiedene Arten von Bauklötzen gestapelt werden, um verschiedene Formen zu bilden, verbinden sich Atome zu verschiedenen Verbindungen.
Interessanterweise unterscheiden sich die Eigenschaften der Verbindungen erheblich von denen der Elemente, aus denen sie bestehen. Das Wassermolekül (H₂O) ist eine Verbindung, in der sich zwei Wasserstoffatome und ein Sauerstoffatom treffen und verbinden. Wasserstoff (H₂), der hauptsächlich in Form eines Moleküls durch Bindung zweier Atome entsteht, ist ein leicht brennbares Gas, das sich bei Kontakt mit der Luft leicht entzündet. Sauerstoff (O₂), der wie Wasserstoff ein zweiatomiges Molekül ist, ist sehr reaktiv und verbindet sich daher direkt mit fast allen Elementen. Wasser, das durch die Verbindung dieser beiden Stoffe entsteht, ist normalerweise flüssig und sehr stabil. Es wird zum Löschen von Feuer verwendet, anstatt andere Stoffe wie Sauerstoff zu verbrennen oder selbst zu brennen wie Wasserstoff.
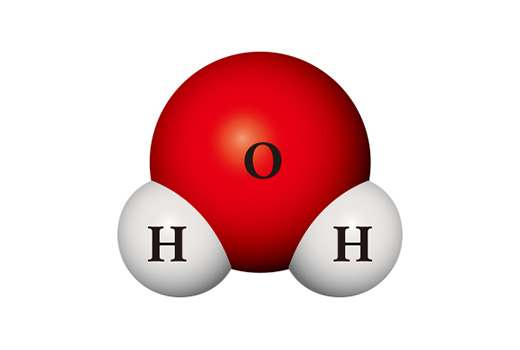
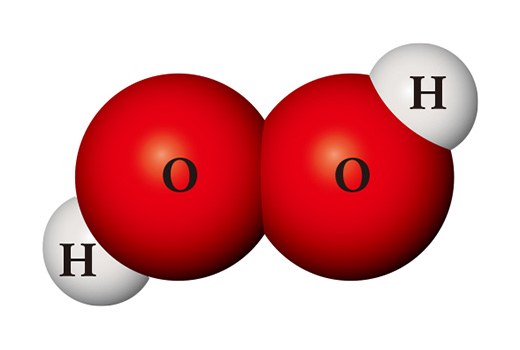
Aus denselben Atomen kann ein völlig anderer Stoff hergestellt werden. Wenn zwei Wasserstoffatome und zwei Sauerstoffatome zusammenkommen, entsteht Wasserstoffperoxid (H₂O₂), das als Desinfektionsmittel verwendet wird. Wasserstoffperoxid ist im Gegensatz zu Wasser so instabil, dass es sich bei Zimmertemperatur leicht in Wasser und Sauerstoff aufspaltet.
So wie man aus Blöcken gleicher Form und Größe verschiedene Dinge herstellen kann, lassen sich auch aus nur einer Art von Element verschiedene Stoffe bilden. Unter ihnen ist Kohlenstoff einzigartig. Sowohl Diamant als auch Grafit bestehen nur aus Kohlenstoff, aber sie haben aufgrund unterschiedlicher Bindungsanordnungen völlig unterschiedliche Eigenschaften.
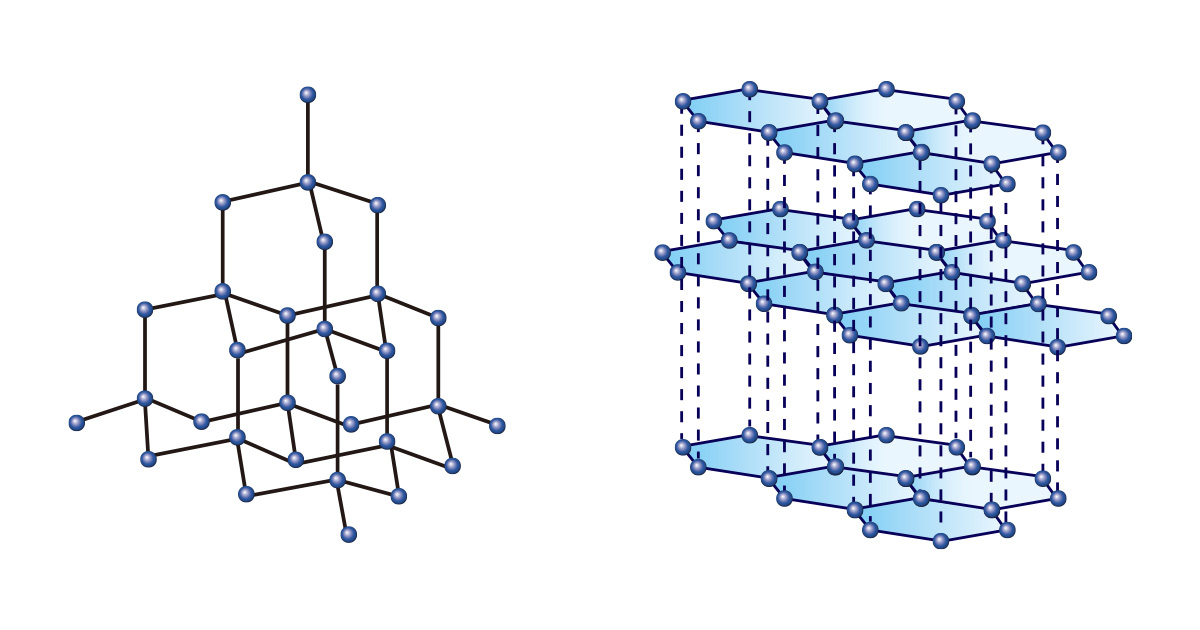
Diamanten, bei denen die Kohlenstoffatome durch Bildung einer tetraedrischen Struktur kontinuierlich miteinander verbunden sind, sind so hart, dass sie nicht nur als Edelsteine für die Ewigkeit gelten, sondern auch in der Industrie zum Schneiden oder Polieren von Materialien verwendet werden. Andererseits wird Grafit, das in Form von gestapelten Schichten aus hexagonalen zweidimensionalen Strukturen vorliegt, als Bleistiftmine verwendet, weil es weich und leicht zu zeichnen ist.

Regeln für die Bildung von Verbindungen
Es gibt bestimmte Regeln, nach denen Atome Verbindungen bilden. Ein Atom besteht aus einem positiv geladenen Kern, der von einem oder mehreren negativ geladenen Teilchen, den Elektronen, umgeben ist. Der Kern eines Atoms enthält Protonen und Neutronen. Da die Anzahl der Protonen und Elektronen in einem Atom gleich ist, ist das Atom selbst elektrisch neutral.
Wissenschaftler gehen davon aus, dass sich die Elektronen je nach Energieniveau um den Atomkern schichten, um den Energiezustand, den die Elektronen einnehmen, einfach zu unterscheiden. Die von den Elektronen gebildete Schicht wird als Elektronenhülle bezeichnet, und für jede Hülle gibt es eine bestimmte Anzahl von Elektronen: 2 Elektronen in der ersten Schicht, 8 Elektronen in der zweiten Schicht und 18 Elektronen in der dritten Schicht.
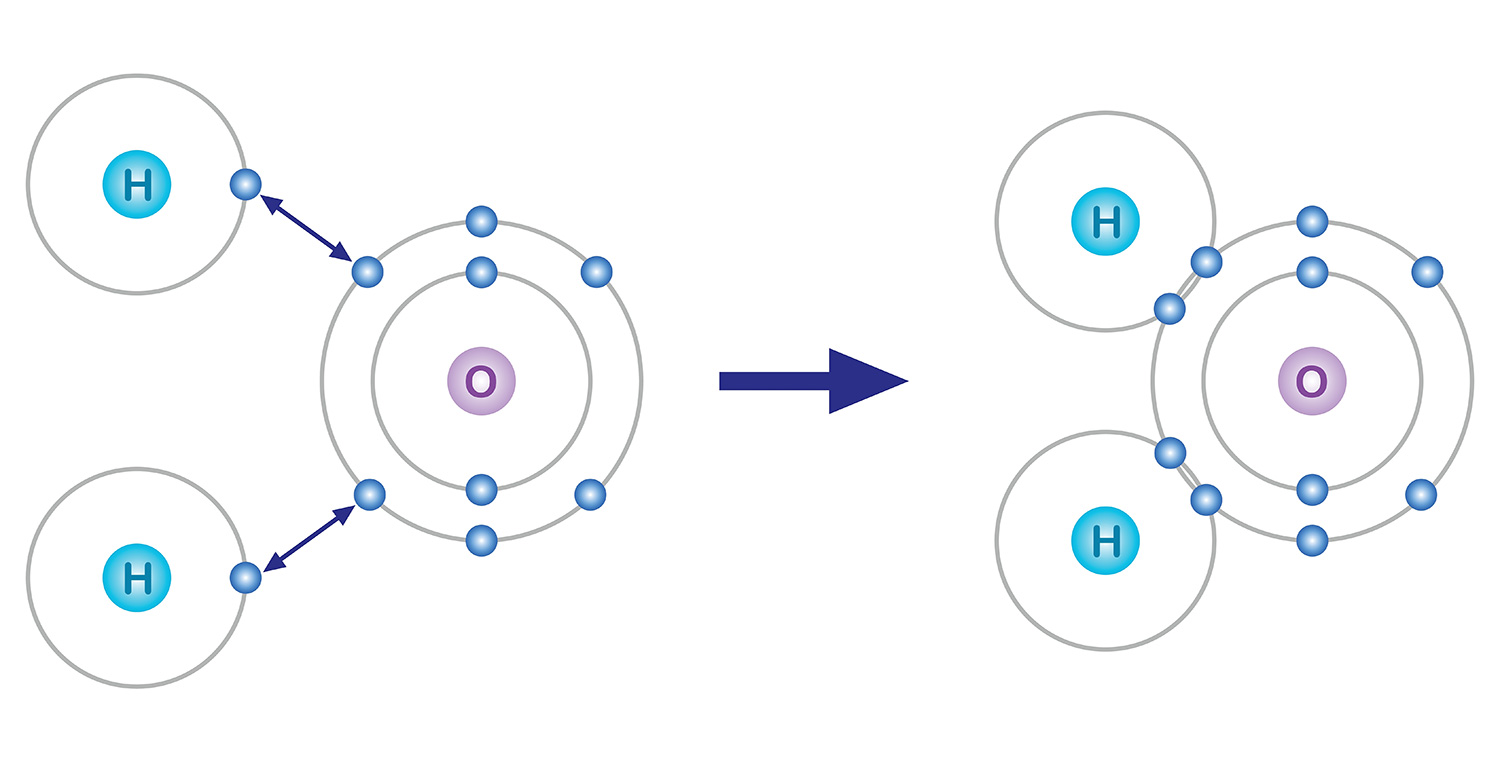
Die Elektronen in der äußersten Schale sind an der chemischen Bindung beteiligt. Atome neigen dazu, acht Elektronen in der letzten Schale zu haben, auch wenn sie dafür Elektronen verlieren oder gewinnen müssen, was als Oktettregel bezeichnet wird. Ein Beispiel: Sauerstoff mit 8 Elektronen hat 2 Elektronen in der ersten Schale und 6 Elektronen in der zweiten Schale. Damit die letzte Schale 8 Elektronen hat, muss eine chemische Bindung eingegangen werden, um 2 weitere Elektronen zu erhalten.
Verschiedene chemische Bindungen
Es gibt verschiedene Möglichkeiten, wie sich ein Atom mit anderen Atomen verbindet. Eine davon ist die kovalente Bindung, eine Win-Win-Strategie, bei der die Atome die Oktettregel erfüllen, indem sie sich gegenseitig die Elektronen geben, als hielten sie sich an den Händen; die Teilchen, die durch die Kombination von Atomen entstehen, werden Moleküle genannt.
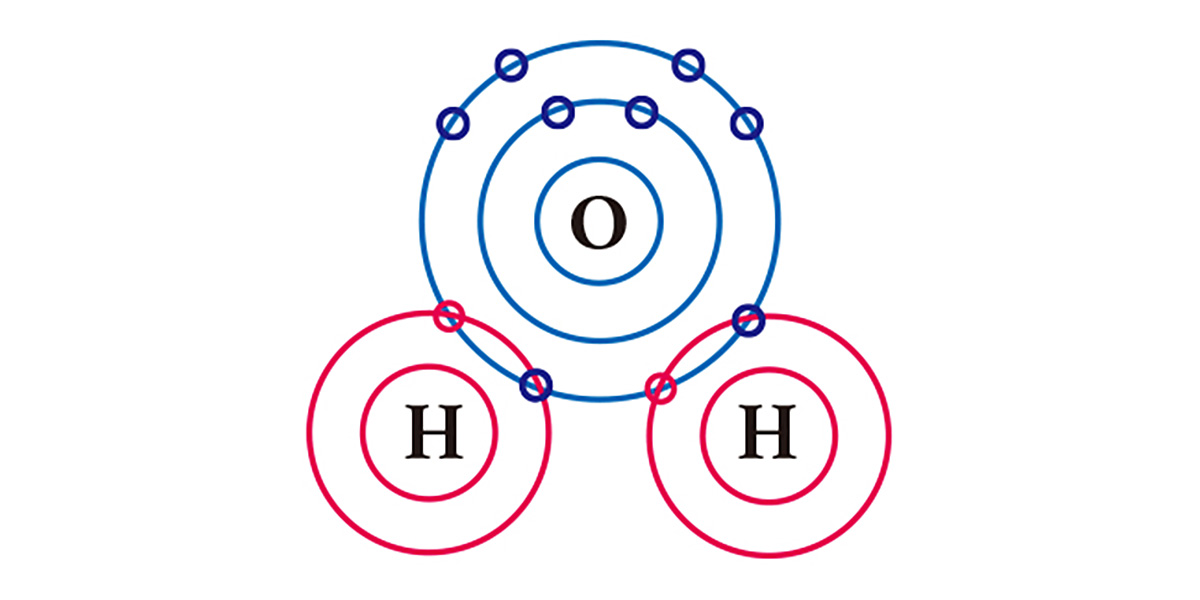
Nehmen Sie zum Beispiel Wasser. Einem Sauerstoffatom, das in seiner äußersten Elektronenhülle 6 Elektronen hat, fehlen 2 Elektronen und einem Wasserstoffatom, das ein Elektron hat, fehlt ein Elektron. Um stabilisiert zu werden, teilt sich ein Sauerstoffatom die beiden Elektronen der beiden Wasserstoffatome in einer kovalenten Bindung, und sie bilden ein Molekül. Sowohl das Sauerstoffatom als auch die Wasserstoffatome haben im Grunde jeweils zwei Elektronen erhalten, indem sie sich jeweils ein Elektron teilen.
Bei Kohlendioxid (CO₂) verbindet sich das Kohlenstoffatom, das vier weitere Elektronen zur Stabilisierung benötigt, mit zwei Sauerstoffatomen und erhält so vier Elektronen (zwei von jedem). Die Bindung zwischen Kohlenstoff und Sauerstoff ist viel stärker als die Bindung zwischen Sauerstoff und Wasserstoff im Wassermolekül. Genauso wie zwei Hände, die sich gegenseitig festhalten, stärker sind als eine Hand, ist auch die Bindung stärker, da die Anzahl der gemeinsamen Elektronen höher ist.
Unter den Elementen gibt es welche, die gerne großzügig geben. Metalle wie Natrium, Aluminium und Eisen erfüllen die Oktettregel und geben ihre restlichen Elektronen leicht ab. Umgekehrt nehmen Nichtmetalle wie Sauerstoff, Stickstoff und Chlor lieber Elektronen auf, als sie abzugeben. Die Bindung zwischen ihnen wird als Ionenbindung bezeichnet. Dabei handelt es sich um eine elektrostatische Bindung, bei der das Metall Elektronen abgibt, um ein positiv geladenes Kation zu werden, während das Nichtmetall diese Elektronen aufnimmt, um ein negativ geladenes Anion zu werden.
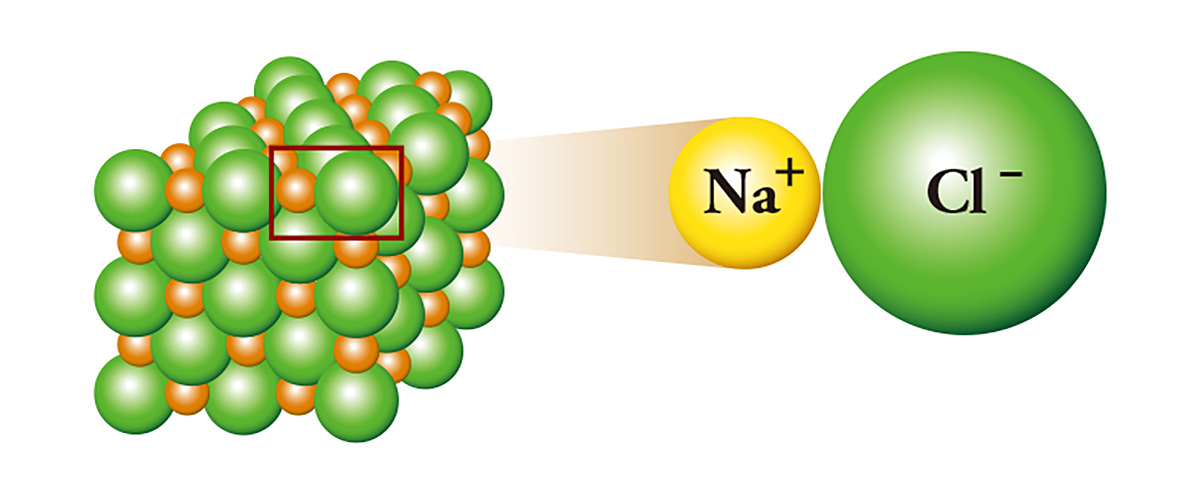
Natriumchlorid (NaCl), das gemeinhin als Salz bezeichnet wird, ist ein Vertreter der Ionenbindung; Natrium, das ein zusätzliches Elektron besitzt, verbindet sich mit Chlor, indem es das Elektron an das Chlor abgibt, dem ein Elektron fehlt. Das Natrium, das das Elektron abgibt, wird zu einem Kation, und das Chlor, das das Elektron erhält, wird zu einem Anion. Dadurch entsteht eine elektrische Anziehung zwischen den beiden Ionen, und sie haften aneinander wie der Nord- und der Südpol eines Magneten und bilden Kristalle. Natrium, ein Metall, das so reaktionsfreudig ist, dass es in Mineralöl oder Kerosin gelagert wird, und Chlor, ein giftiger Stoff, der als Giftgas verwendet wird, treffen aufeinander und werden zu Salz.
Metallische Bindungen sind in festen Metallen zu finden, die aus einer einzigen Atomart bestehen, wie Gold oder Aluminium. Es handelt sich um eine Art chemischer Bindung zwischen positiv geladenen Atomen, bei der die freien Elektronen auf ein Gitter von Kationen aufgeteilt werden; die delokalisierten Elektronen bewegen sich frei zwischen den Kationen und halten die Bindung aufrecht.
Atome gehen eine Bindung ein, indem sie Elektronen teilen oder austauschen. Manchmal kommen gefährliche Stoffe zusammen, um eine Verbindung zu bilden, die stabiler ist als alle anderen Verbindungen, und je nachdem, wie sie kombiniert werden, werden sie schwächer oder stärker. In der Welt der Teilchen sind die Atome miteinander verbunden und bilden völlig unterschiedliche Stoffe.
Die meisten Stoffe bestehen aus nur etwa 20 Elementen. Wenn diese wenigen Elemente jedoch miteinander kombiniert werden, können viele verschiedene Verbindungen entstehen. Laut Chemical Abstract Service [CAS] gibt es mehr als 140 Millionen Chemikalien auf der Erde, und jeden Tag werden mehr als 10.000 neue Verbindungen registriert (Stand: April 2018). Da es noch viele gibt, die noch nicht entdeckt wurden, wird die Zahl der Chemikalien noch höher sein. Das Geheimnis der Mikrowelt, die eine unzählige Vielfalt von Verbindungen hervorbringt, ist wirklich rätselhaft.