
この世の中は、ありとあらゆる物質で満ちている。周辺を少し見渡しただけでも、水や空気、石のような自然由来のものから、プラスチックやビニールのような人工的なものにいたるまで、すべて物質によって構成されている。こんな物質を分け続けていくと、何になるのか?これ以上分けることができない単位まで分けていくと、その時初めて世の中の基本単位である“原子”に到達する。
万物を構成する基本要素として、一種類の原子だけでできた純粋な物質を“元素”という。私たちが知っている元素は、計110種余り。そのうち自然の中から発見される元素は90種余りに過ぎない。しかも、よく発見される元素はせいぜい40種余りに過ぎない。
化学結合の神秘
あるテーマパークには、色とりどりの小さな四角いブロックで出来た村がある。ブロックを積み上げて、ランドマークとなる大きな建築物に始まって、自動車や公園のブランコまで作ることができるとは驚きだ。このように、私たちの周辺に存在する物質も、大半が二つ以上の元素が結合してできた化合物だ。いくつかの種類のブロックを積み上げて多様な形を作り出すように、原子が結合して多様な構造をした化合物が作られるのである。
不思議なことに、化合物の性質は構成元素の性質とは全く異なる。水の分子(H₂O)は水素原子二個と酸素原子一個が結合した化合物である。主に二つの原子が結合して、分子状態にある水素は燃焼しやすい気体なので、空気と接触すると簡単に燃焼する。水素と同様に二原子分子で存在する酸素は反応性が大きく、ほとんど全ての元素と結合する。このような二つの物質が出会ってできた水は、主に液体で存在し、非常に安定している。酸素や水素のように、他の物質を燃やしたり自ら燃焼したりするよりは、むしろ火を消すのに使われる。
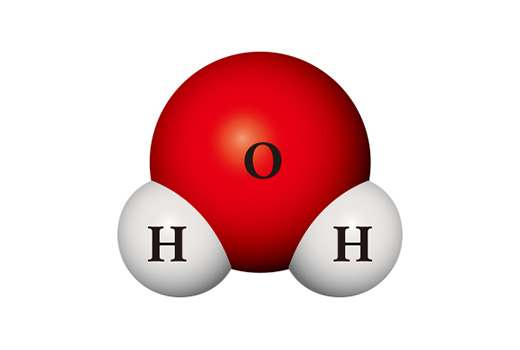
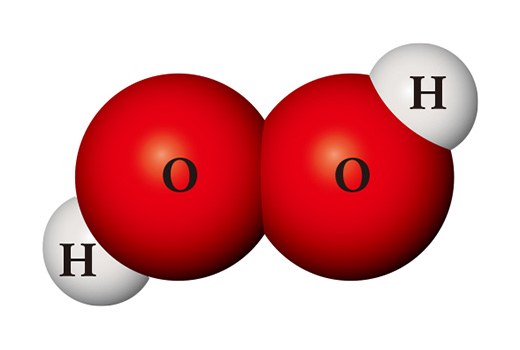
同じ原子を材料としていても、全く異なる物質が作られる場合もある。水素原子二個と酸素原子二個が出会うと、消毒薬としても使われる過酸化水素になる。過酸化水素は水と違って非常に不安定で、常温で簡単に水と酸素に分解されてしまう。
形と大きさが同じブロックで多様な形を作ることができるように、一種類の元素だけでも多様な物質が形成される。中でも、炭素は独歩的だ。ダイヤモンドと黒鉛は、いずれも炭素だけでできているが、結合配列構造が違うため、まったく異なる性質を見せる。
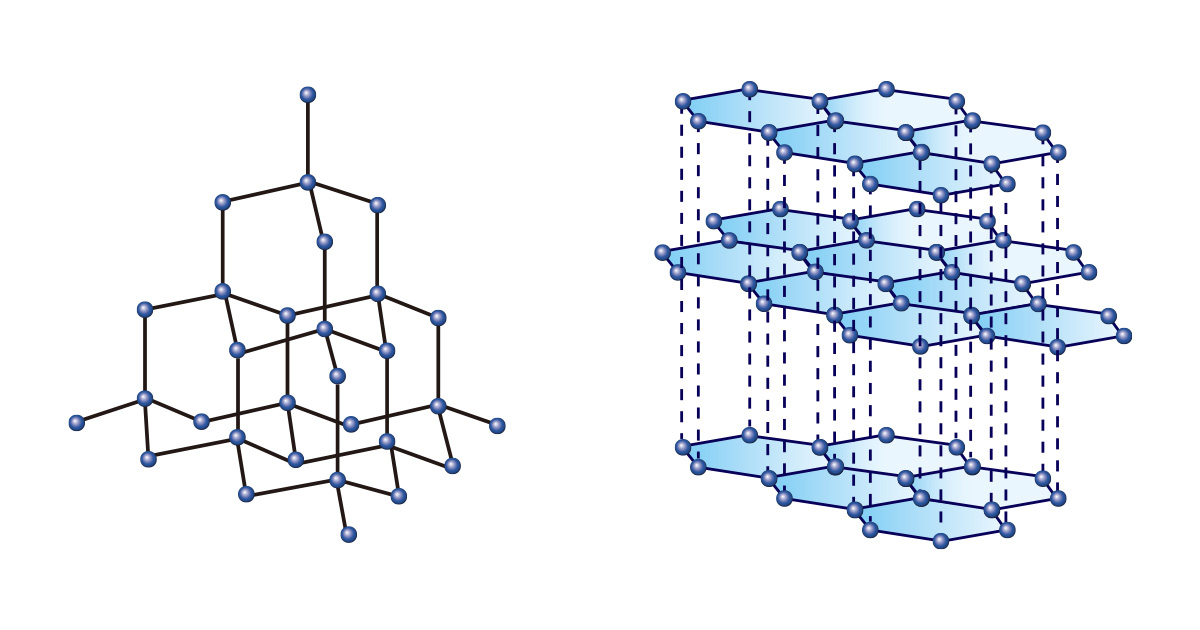
炭素原子が正四面体構造をなしながら連続的に結合しているダイヤモンドは、非常に丈夫で永遠を象徴する宝石であるだけでなく、工業的には物質を切削したり研磨するのに使われる。一方、正六角形の二次元構造が積み重なった形の黒鉛は、柔らかいので鉛筆の芯として使われる。

化合物の製造規則
原子が集まって化合物を作るにも、それなりの規則がある。原子の中には陽電荷を帯びる原子核があり、陰電荷を帯びる電子がその周りを回っている。原子核はまた陽子と中性子で構成されているが、原子に含まれる陽子と電子の個数が同じであるため、原子自体は電気的に中性である。
科学者たちは、電子が取るエネルギー状態を簡単に区別するために、原子核を中心にエネルギーのレベルによって電子が複数の層を成すと仮定する。その時、電子が構成する層を「電子の殻」と言うが、殻ごとに定員が決まっていて、一階には二個、二階には八個、三階には十八個の電子が入ることができる。
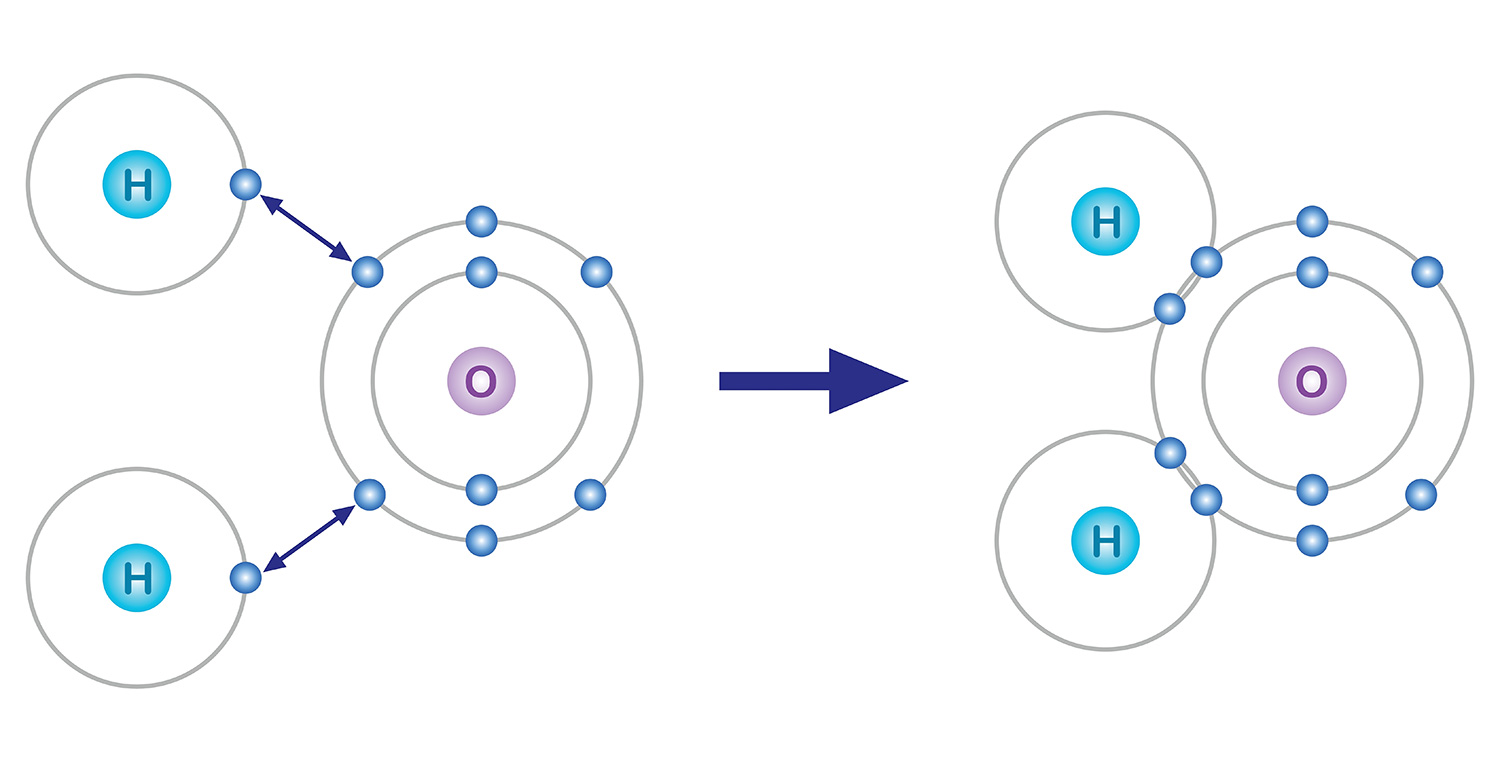
その中でも最も外側にある電子が化学結合に参加する。原子は電子を失ったり得たりしても最後の殻に八つの電子を持とうとする傾向があるが、これを「オクテット則」という。例えば、八個の電子を持つ酸素は、最初の殻に二個、二番目の殻に六個の電子が含まれる。そのため、最後の殻に八つの電子を入れるためにさらに二つの電子を得る方向で化学結合をする。
さまざまな化学結合
原子が他の原子と結合する方法は非常に多様である。その一つが「共有結合」である。この時、原子は手を取り合うようにお互いの電子を共有し、オクテット則を満たす「win-win戦略」を使う。この時、原子が結合してできた粒子を「分子」という。
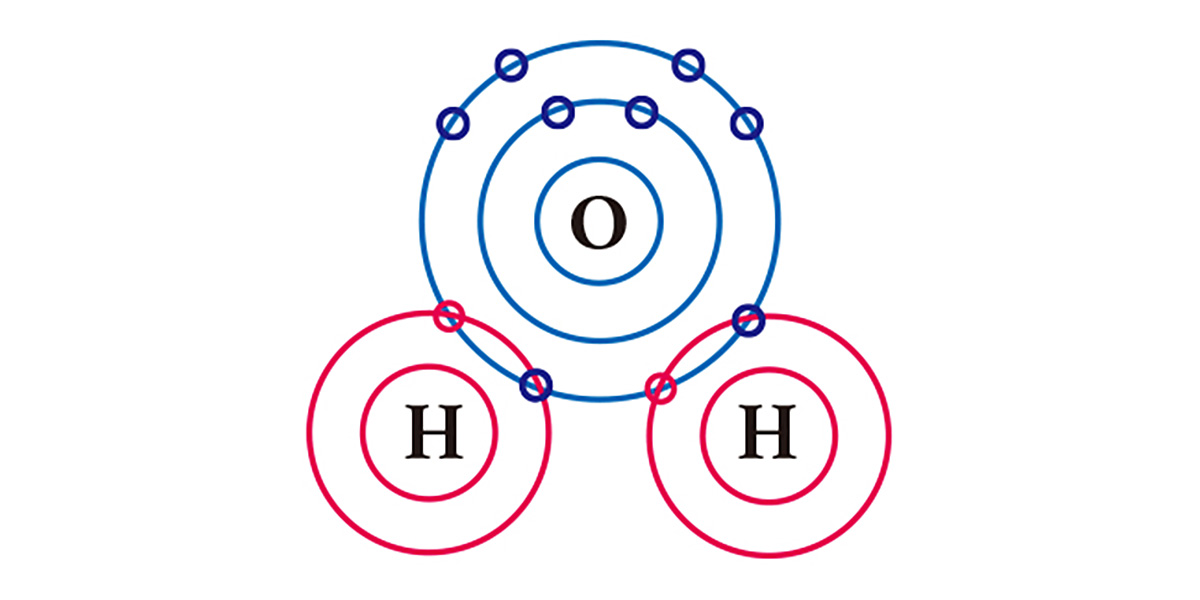
水を例にとってみよう。最後の殻に六つの電子を持つ酸素は電子が二つ不足し、一つの電子を持つ水素は一つ不足している。そのため、酸素は二つの水素とそれぞれ電子を一つずつ共有して安定し、一つの分子を成す。酸素と水素いずれも一つの電子を出すことで、二つの電子を得たことになる。
二酸化炭素の場合、さらに四つの電子が必要な炭素が二つの酸素とそれぞれ二つの電子を共有して結合する。この時、炭素と酸素の結合は水の分子の酸素と水素の結合よりずっと強い。片手より両手を取り合う方がより強いように、原子と原子の間で共有する電子が多くなり、結合の強度が強くなったのだ。
元素の中には、惜しみなく与えることを好む元素がある。ナトリウム、アルミニウム、鉄などの金属元素は、オクテット則を満たして残った電子をいとも簡単に差し出す。反対に酸素、窒素、塩素のような非金属元素は、電子を与えるよりももらうことを好む。これらの間の結合を「イオン結合」というが、電子を失って陽イオンになった金属元素と、電子を得て陰イオンになった非金属元素との間の静電気的結合をなすもののことをいう。
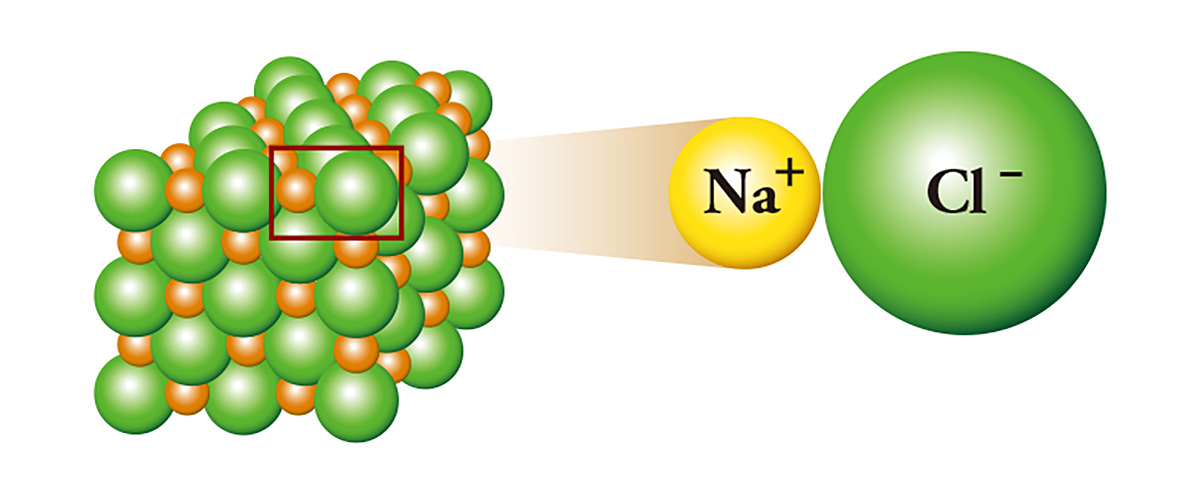
よく、塩と呼ばれる塩化ナトリウム(NaCl)は代表的なイオン結合物質で、電子が一つ残るナトリウムが電子が一つ不足した塩素に電子を与えることで結合する。電子を与えたナトリウムはプラスイオンになり、電子をもらった塩素はマイナスイオンになる。その結果、二つのイオンの間に電気的な引きつけが生じ、磁石のN極とS極のように互いにくっつき合いながら結晶を成す。石油に入れて保管するほど反応性の高い金属のナトリウムと、毒ガスとして使われるほど有毒な物質の塩素が出会って塩になるのだ。
金やアルミニウムのように一種類の原子からなる固体金属に見られる金属結合は、金属原子が核と結合力の弱い外側の電子を送り出して陽イオンとなって、一定の配列を成すものだ。逃れた電子は陽イオンの間を自由に移動して結合を維持させる。電子を出して陽イオンになった原子が、一方では電子を共有する。
原子は電子を共有するなど、やり取りしながら結合する。危険な物質が集まって何よりも安定した化合物を形成したり、どのように結合するかによって弱くなったりする。これは、微粒子の世界で和合した原子が、全く異なる化合物を誕生させるということだ。
大半の物質は、約20個の元素だけで構成されている。しかし、少ない数の元素が結合して作られる化合物は、非常に多種多様だ。ケミカル アブストラクツ サービス(CAS、Chemical Abstracts Service)によると、全地球上にある化学物質はなんと1億4千万種類以上に及び、毎日1万以上の新しい化合物が登録されている(2018年 4月基準)。まだ発見されていないものまで考慮すれば、その数はさらに増えるだろう。数え切れないほど多様な化合物を作り出すミクロの世界の理は、実に神秘的だ。