
세상은 물질로 가득 차 있다. 주변을 조금만 둘러봐도 물과 공기, 돌 같은 자연적인 것에서부터 플라스틱과 비닐같이 인공적인 것까지 모두 물질로 이뤄져 있다. 이런 물질을 쪼개고 쪼개면 무엇이 될까? 더는 나눌 수 없을 만큼 나누면 비로소 세상의 기본 단위인 원자가 된다.
만물을 구성하는 기본 요소로, 한 종류의 원자로만 이루어진 순수한 물질을 원소라고 한다. 우리에게 알려진 원소는 모두 110여 종이며 그중 자연에서 발견되는 원소는 90여 가지밖에 되지 않는다. 게다가 흔히 발견되는 원소는 고작해야 40여 종에 불과하다.
화학결합의 신비
한 테마파크에는 색색의 네모나고 자그마한 블록 조각으로 탄생시킨 마을이 있다. 블록을 쌓아 올려, 랜드마크로 꼽히는 커다란 건축물부터 자동차와 놀이터의 그네까지 만들 수 있다니 놀라울 따름이다. 이와 마찬가지로 우리 주변에 존재하는 물질들도 대부분 두 가지 이상의 원소가 결합해서 생긴 화합물이다. 몇 종류의 블록을 쌓아 올려 다양한 모양을 만들어내듯, 원자들이 결합하여 다양한 구조의 화합물이 만들어지는 것이다.
신기하게도 화합물의 성질은 구성 원소들의 성질과는 판이하게 다르다. 물 분자(H₂O)는 수소 원자 2개와 산소 원자 1개가 만나 결합한 화합물이다. 주로 두 개의 원자가 결합하여 분자 상태로 있는 수소(H₂)는 연소하기 쉬운 기체로 공기와 접촉하면 쉽게 불이 붙는다. 수소와 마찬가지로 이원자 분자로 존재하는 산소(O₂)는 반응성이 커서 거의 모든 원소와 결합한다. 이런 두 물질이 만나 생긴 물은 주로 액체 상태로 존재하며 매우 안정하다. 산소나 수소처럼 다른 물질을 태우거나 스스로 타기보다는 오히려 불을 끄는 데 사용된다.
같은 원자들을 재료로 전혀 다른 물질이 만들어질 수도 있다. 수소 원자 2개와 산소 원자 2개가 만나면 소독약으로도 쓰이는 과산화수소(H₂O₂)가 된다. 과산화수소는 물과 달리 매우 불안정해서 상온에서 쉽게 물과 산소로 분해되어 버린다.
모양과 크기가 똑같은 블록 조각으로 다양한 모양을 만들 수 있듯, 한 종류의 원소만으로도 여러 가지 물질이 형성된다. 그중에서도 탄소는 독보적이다. 다이아몬드와 흑연은 모두 탄소로만 이뤄져 있지만 결합 배열 구조가 달라 완전히 다른 성질을 보인다.
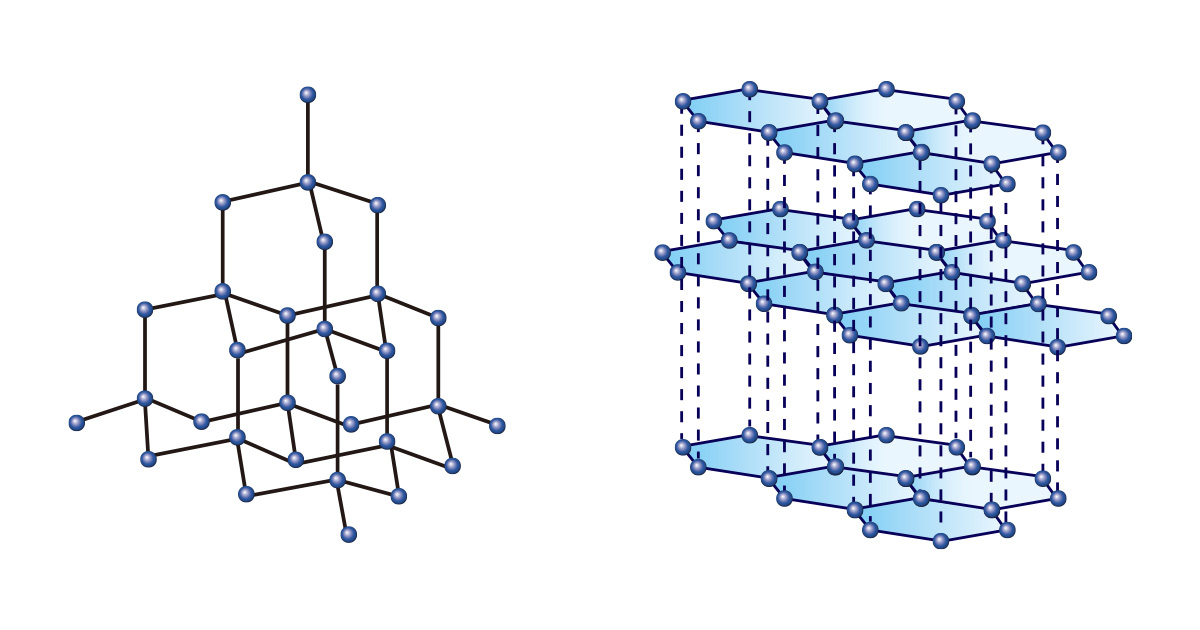
탄소 원자가 정사면체 구조를 이루며 연속적으로 결합해 있는 다이아몬드는 매우 단단해 영원을 상징하는 보석일 뿐만 아니라 공업적으로는 물질을 절삭하거나 연마하는 데 사용된다. 반면, 정육각형의 2차원 구조가 겹겹이 쌓여 있는 형태의 흑연은 무르고 잘 묻어나 연필심으로 쓰인다.

화합물을 만드는 규칙
원자들이 모여 화합물을 이루는 데에도 나름의 규칙이 있다. 원자 속에는 양전하를 띠는 원자핵이 있고, 음전하를 띠는 전자가 그 주위를 돌고 있다. 원자핵은 다시 양성자와 중성자로 구성되어 있는데, 원자에 포함된 양성자와 전자의 개수가 같기 때문에 원자 자체는 전기적으로 중성이다.
과학자들은 전자들이 취하는 에너지 상태를 간단히 구별하기 위해 원자핵을 중심으로 에너지 준위에 따라 전자들이 여러 층을 이룬다고 가정한다. 그때 전자가 이루는 층을 ‘전자껍질’이라고 하는데, 껍질마다 정원이 정해져 있어서 첫 번째 층에는 2개, 두 번째 층에는 8개, 세 번째 층에는 18개의 전자가 들어갈 수 있다.
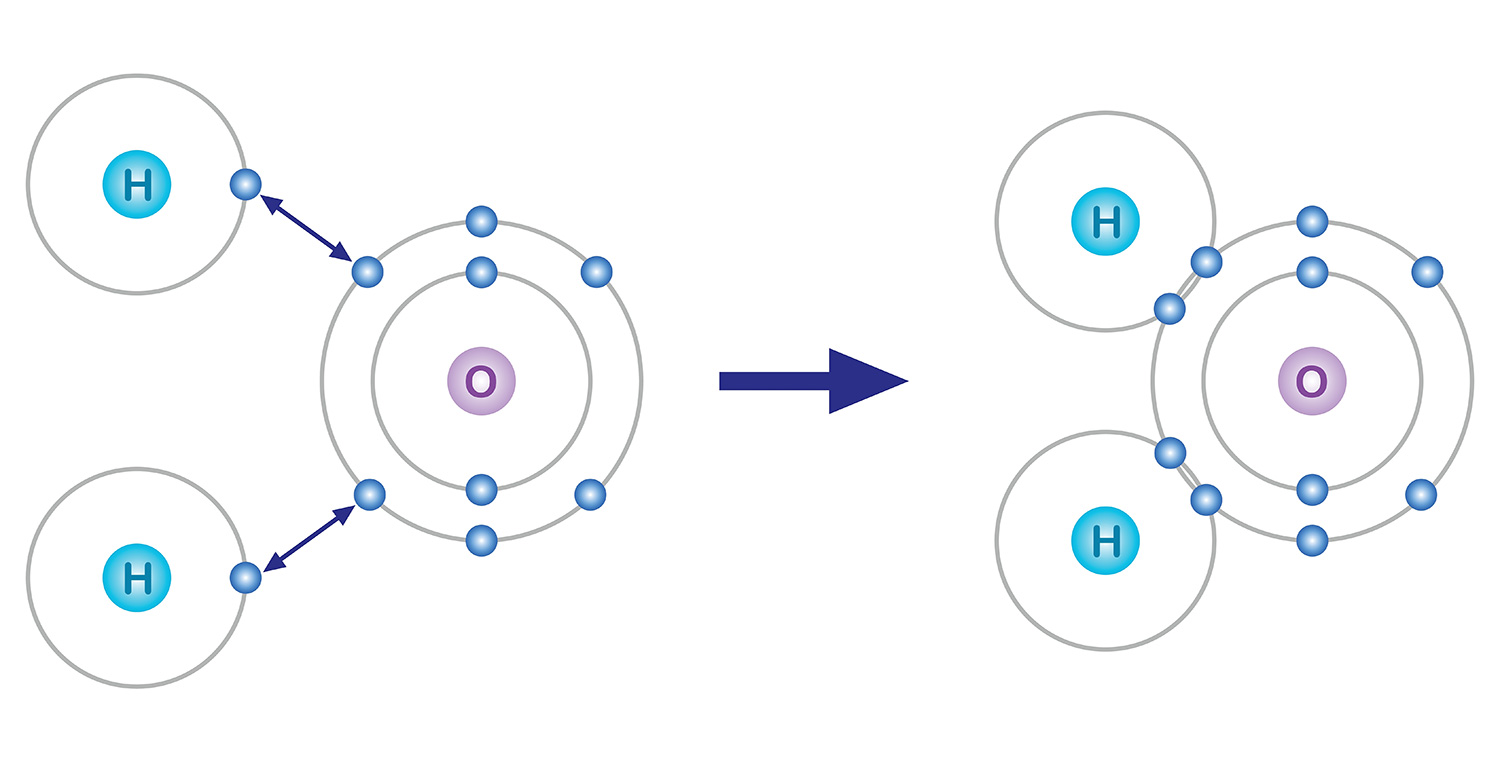
그중에서도 가장 바깥 껍질에 있는 전자들이 화학결합에 참여한다. 원자들은 전자를 잃거나 얻어서라도 가장 마지막 껍질에 8개의 전자를 가지려는 경향이 있는데, 이를 ‘옥텟 규칙’이라고 한다. 예를 들어, 8개의 전자를 가진 산소는 첫 번째 껍질에 2개, 두 번째 껍질에 6개의 전자가 포함된다. 그러므로 마지막 껍질에 전자 8개를 채우기 위해 2개의 전자를 더 얻는 방향으로 화학결합을 한다.
여러 가지 화학결합
원자가 다른 원자와 결합하는 방법은 매우 다양하다. 그중의 하나가 바로 ‘공유결합’이다. 이때 원자들은 손을 마주 잡듯 서로의 전자를 공유하여 옥텟 규칙을 충족시키는 윈윈 전략을 사용한다. 이때 원자들이 결합하여 만들어 낸 입자를 ‘분자’라고 한다.
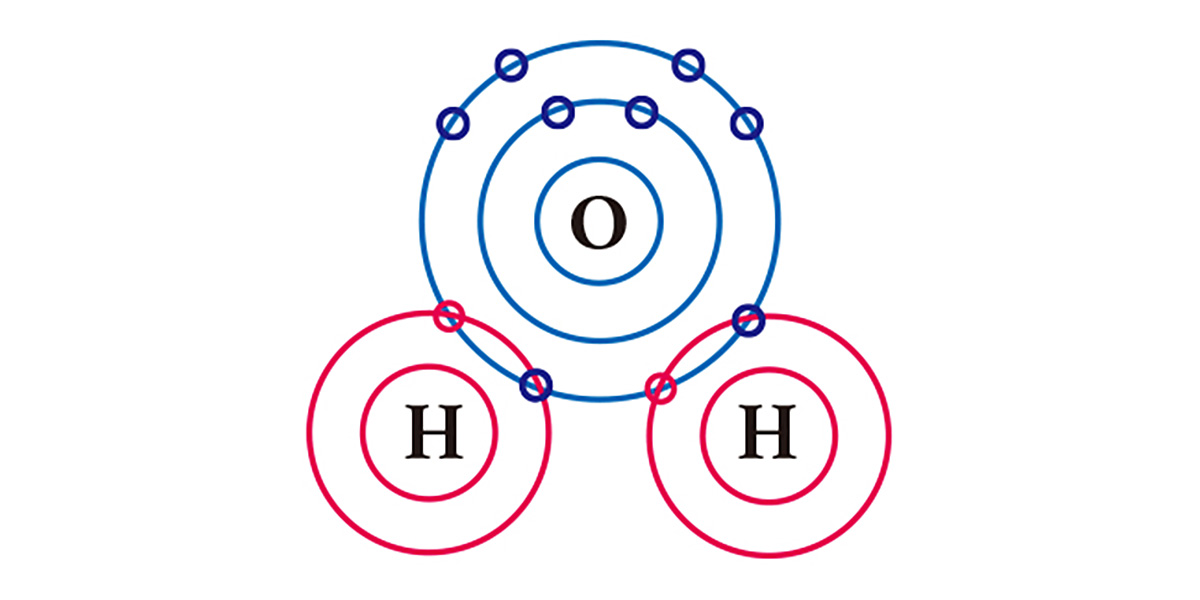
물을 예로 들어보자. 마지막 껍질에 6개의 전자를 갖는 산소는 2개의 전자가 부족하고, 1개의 전자를 갖는 수소는 1개가 부족하다. 그래서 산소는 두 개의 수소와 각각 전자 1개씩을 공유하여 안정해지며 하나의 분자를 이룬다. 산소와 수소 모두 1개의 전자를 내놓는 것으로 2개의 전자를 얻은 셈이 된다.
이산화탄소(CO₂)의 경우는 4개의 전자가 더 필요한 탄소가 2개의 산소와 각각 2개의 전자를 공유하여 결합한다. 이때 탄소와 산소의 결합은 물 분자의 산소와 수소의 결합보다 훨씬 강하다. 한 손보다 두 손을 마주 잡는 것이 더 강한 것처럼 원자와 원자 사이에 공유하는 전자가 많아져 결합의 강도가 세진 것이다.
원소 중에는 아낌없이 내주기를 좋아하는 원소들이 있다. 나트륨, 알루미늄, 철과 같은 금속원소들은 옥텟 규칙을 채우고 남는 전자를 쉽게 내놓는다. 반대로 산소, 질소, 염소와 같은 비금속원소들은 전자를 주기보다는 받기를 좋아한다. 이들 사이의 결합을 ‘이온결합’이라 하는데, 전자를 잃고 양이온이 된 금속원소와 전자를 얻어 음이온이 된 비금속원소 사이에 정전기적 결합을 이루는 것을 말한다.
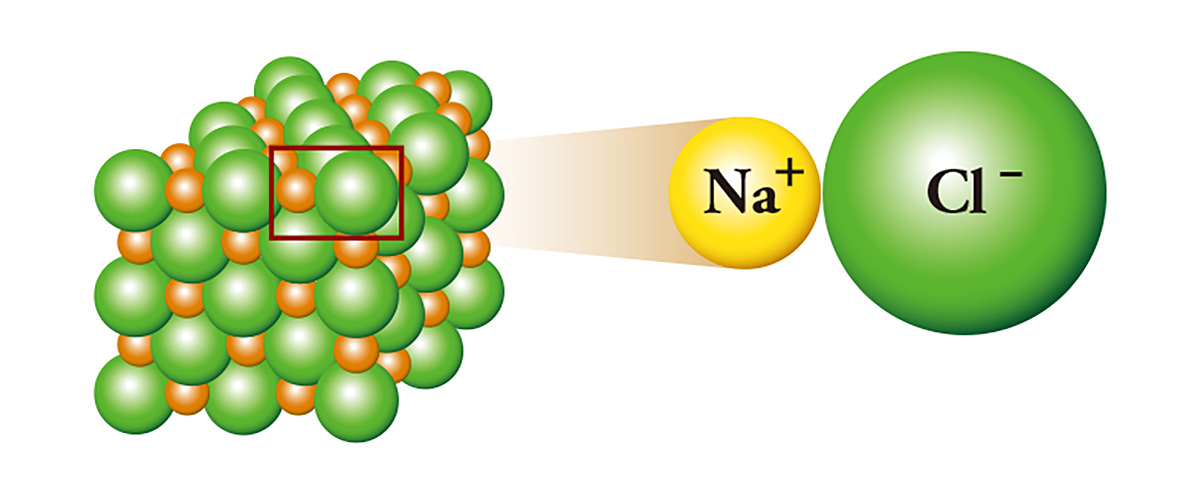
흔히 소금으로 불리는 염화나트륨(NaCl)은 대표적인 이온결합 물질로, 전자가 하나 남는 나트륨이 전자가 하나 부족한 염소에게 전자를 줌으로써 결합한다. 전자를 준 나트륨은 양이온이 되고, 전자를 받은 염소는 음이온이 된다. 그 결과, 두 이온 사이에 전기적인 끌어당김이 생기고 자석의 N극과 S극처럼 서로 들러붙어 차곡차곡 쌓이며 결정을 이룬다. 석유에 넣어서 보관할 만큼 반응성이 큰 금속인 나트륨과, 독가스로 사용될 만큼 유독한 물질인 염소가 만나 소금이 되는 것이다.
금이나 알루미늄같이 한 종류의 원자로 이뤄진 고체 금속에서 볼 수 있는 금속결합은 금속 원자들이 핵과 결합력이 약한 바깥쪽 전자를 내놓고 양이온이 되어 일정한 배열을 이루는 것이다. 빠져나온 전자들이 양이온 사이를 자유롭게 이동하며 결합을 유지시킨다. 전자를 내놓고 양이온이 된 원자들이 한편으로는 내놓은 전자들을 함께 공유한다.
원자들은 전자를 공유하거나 주고받아 결합한다. 위험한 물질들이 모여 무엇보다 안정한 화합물을 이루기도 하고, 어떻게 결합하느냐에 따라 약해지거나 강해지기도 한다. 미립자의 세계에서 화합(和合)한 원자들이 전혀 다른 화합물(化合物)을 탄생시키는 것이다.
대부분의 물질은 20여 개의 원소로만 구성되어 있다. 그러나 적은 수의 원소들이 합쳐져 만들 수 있는 화합물은 무척 다양하다. 화학 초록 서비스CAS, Chemical Abstracts Service에 따르면 전 지구 상에 있는 화학물질은 무려 1억 4천만 가지 이상에 달하며 매일 1만 개 이상의 새로운 화합물이 등록되고 있다고 한다(2018년 4월 기준). 아직 발견되지 않은 것까지 감안하면 그 수는 더욱 많아질 것이다. 헤아릴 수 없을 만큼 다양한 화합물을 만들어내는 미시 세계의 이치가 참으로 신비하다.