
Thế giới chứa đầy những hạt vật chất. Chỉ cần nhìn thoáng qua xung quanh chúng ta cũng đủ để thấy rằng những vật chất tự nhiên như nước, không khí và đá sỏi, cũng như những vật chất nhân tạo như nhựa hay vinyl đều được tạo nên từ những hạt vật chất. Điều gì sẽ xảy ra nếu chúng ta tiếp tục phân chia vật chất này thành những mảnh nhỏ hơn? Nếu phân chia chúng đến mức không thể phân chia được nữa, chúng ta có atom – nguyên tử, là đơn vị cơ bản của vật chất.
Vật chất tinh khiết của một loại nguyên tử được gọi là nguyên tố. Có khoảng 110 nguyên tố đã được phát hiện và khoảng 90 trong số đó được tìm thấy trong tự nhiên. Trong đó, chỉ có khoảng 40 nguyên tố là phổ biến.
Bí ẩn của liên kết hóa học
Trong công viên giải trí nọ có một ngôi làng được làm bằng những khối nhỏ đầy màu sắc. Thật đáng kinh ngạc là các tòa nhà to lớn được coi là địa điểm cột mốc, ô tô và thậm chí xích đu trong khu vui chơi ấy cũng có thể được tạo ra bằng cách xếp các khối này lại với nhau. Tương tự như vậy, hầu hết các vật chất xung quanh chúng ta là hợp chất từ sự kết hợp của hai hoặc nhiều nguyên tố. Giống như một số loại khối hộp được xếp chồng lên nhau để tạo thành các hình dạng khác nhau, các nguyên tử cũng kết hợp để tạo thành nhiều hợp chất đa dạng.
Điều thú vị là tính chất của các hợp chất lại khác biệt đáng kể so với tính chất của các nguyên tố cấu thành. Phân tử nước (H₂O) là một hợp chất trong đó hai nguyên tử hydro liên kết với một nguyên tử oxy. Hydro (H₂) chủ yếu ở dạng phân tử do hai nguyên tử liên kết với nhau, là một chất khí dễ cháy và dễ bắt lửa khi tiếp xúc với không khí. Oxy (O₂), là một phân tử nguyên tử (là phân tử chỉ gồm hai nguyên tử) giống như hydro, có tính phản ứng cao và do đó nó có thể kết hợp trực tiếp với hầu hết các nguyên tố. Tuy nhiên, nước là chất được tạo thành bởi sự liên kết của hai nguyên tố này lại thường ở dạng lỏng và rất ổn định. Nước được sử dụng để dập lửa thay vì đốt cháy các vật liệu khác hoặc tự cháy như oxy hay hydro.
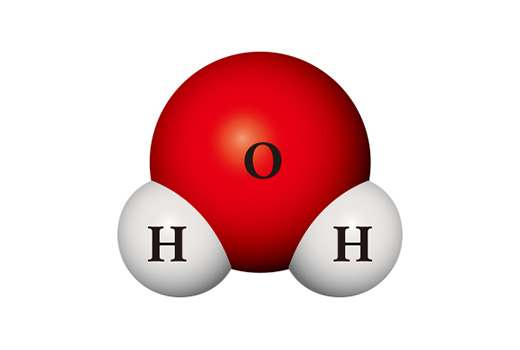
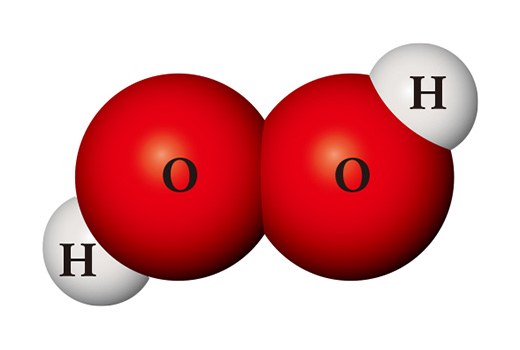
Một chất hoàn toàn khác cũng có thể được tạo ra từ các loại nguyên tử giống nhau. Khi hai nguyên tử hydro và hai nguyên tử oxy gặp nhau, chúng trở thành nước oxy già (H₂O₂) được sử dụng làm chất khử trùng. Oxy già không ổn định như nước nên nó dễ dàng bị phân hủy thành nước và oxy ở nhiệt độ phòng.
Cũng giống như quý vị có thể tạo ra nhiều vật dụng khác nhau bằng cách sử dụng các khối hộp có cùng hình dạng và kích thước, nhiều loại vật chất có thể được tạo thành chỉ bởi một loại nguyên tố. Trong số đó, carbon là điển hình nhất. Cả kim cương và than chì đều được tạo thành chỉ từ carbon, nhưng chúng có các tính chất hoàn toàn khác nhau do sự sắp xếp liên kết khác nhau.
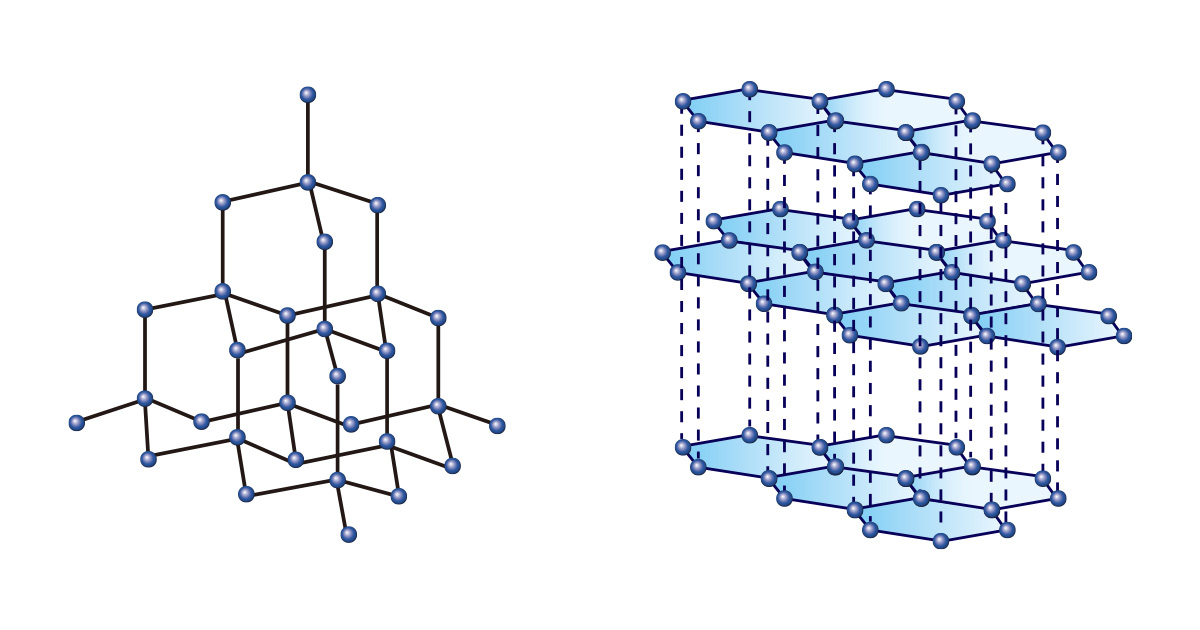
Kim cương được tạo ra bởi các nguyên tử cacbon liên kết liên tục theo cấu trúc tứ diện nên rất cứng, chúng được coi là loại đá quý tượng trưng cho sự vĩnh cửu và được sử dụng để cắt hoặc đánh bóng vật liệu trong lĩnh vực công nghiệp. Ngược lại, than chì được tạo ra bởi những cấu trúc hai chiều hình lục giác xếp chồng lên nhau thì được sử dụng làm bút chì vì nó mềm và dễ vẽ.

Quy tắc hình thành hợp chất
Có những quy tắc nhất định để các nguyên tử tạo thành hợp chất. Nguyên tử bao gồm một hạt nhân mang điện tích dương được bao quanh bởi một hoặc nhiều hạt mang điện tích âm gọi là electron. Hạt nhân của nguyên tử chứa proton và neutron. Vì số proton và electron chứa trong một nguyên tử là bằng nhau nên bản thân nguyên tử là hạt trung hòa về điện.
Các nhà khoa học giả định rằng các electron được xếp lớp xung quanh hạt nhân nguyên tử theo mức năng lượng để phân biệt một cách đơn giản mức năng lượng mà các electron có. Lớp được tạo thành bởi các electron được gọi là lớp vỏ electron và có một số lượng hạt electron cố định mà mỗi lớp vỏ có thể chứa: 2 electron ở lớp thứ nhất (tính từ hạt nhân), 8 electron ở lớp thứ hai và 18 electron ở lớp thứ ba.
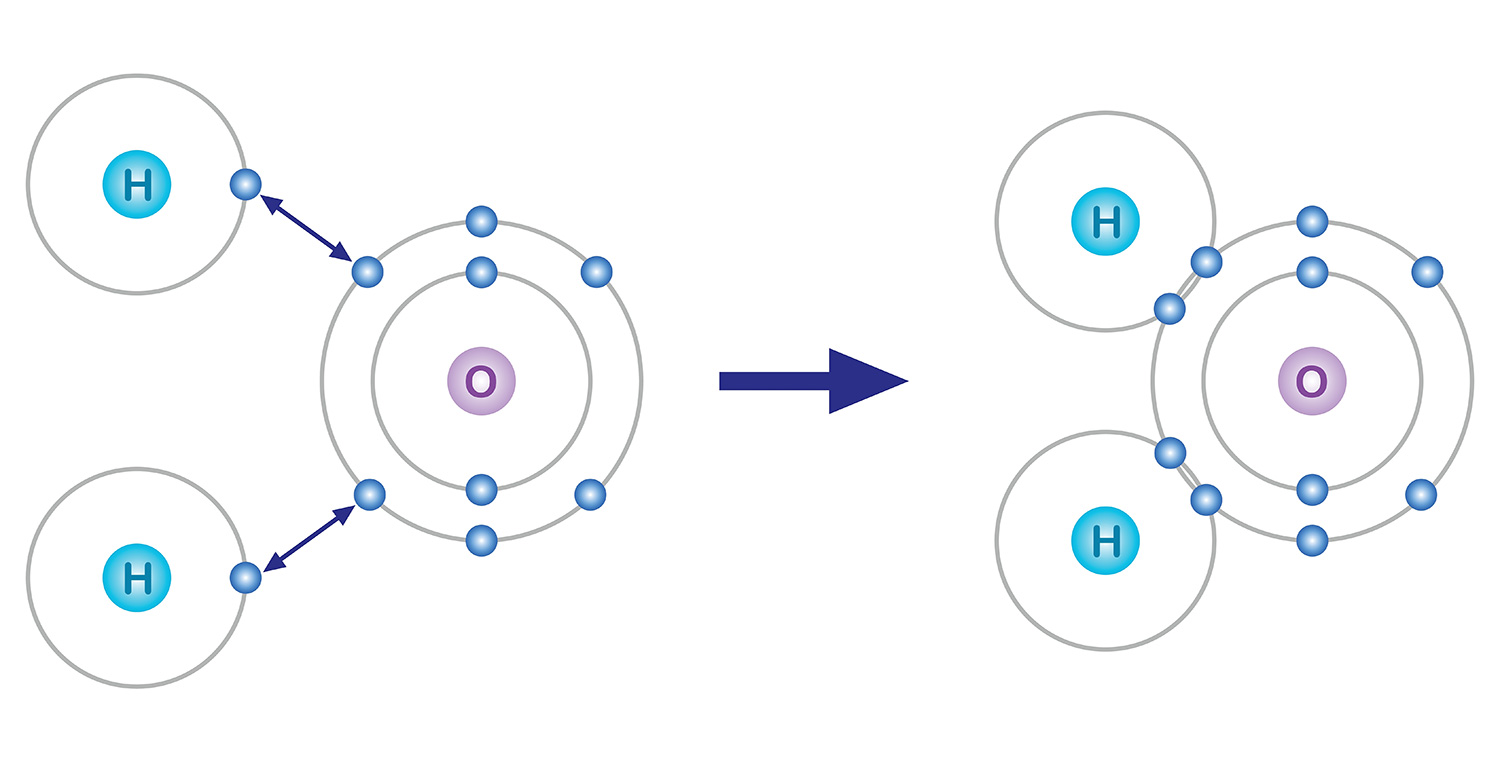
Trong số đó, các electron ở lớp vỏ ngoài cùng sẽ tham gia vào liên kết hóa học. Nguyên tử có xu hướng duy trì 8 electron ở lớp vỏ ngoài cùng ngay cả khi chúng phải bỏ bớt hoặc nhận thêm electron. Đây được gọi là quy tắc bát tử. Ví dụ, oxy có 8 electron, gồm 2 electron ở lớp vỏ thứ nhất và 6 electron ở lớp vỏ thứ hai. Do đó, để lớp vỏ ngoài cùng có 8 electron thì phải tạo liên kết hóa học để nhận thêm 2 electron.
Các liên kết hóa học đa dạng
Có nhiều cách khác nhau để một nguyên tử kết hợp với các nguyên tử khác. Một trong số đó là liên kết cộng hóa trị, một chiến lược đôi bên cùng có lợi mà trong đó các nguyên tử thỏa mãn quy tắc bát tử bằng cách chia sẻ các electron của nhau như thể chúng đang nắm tay nhau; các hạt được tạo ra bởi sự kết hợp của các nguyên tử được gọi là “phân tử”.
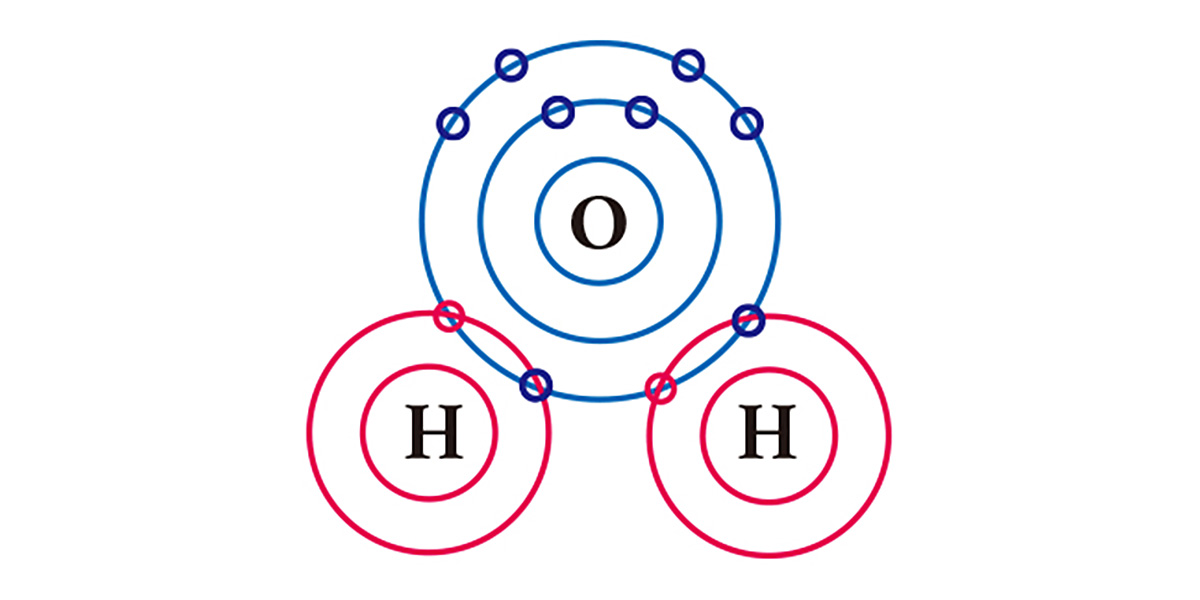
Lấy ví dụ về nước. Một nguyên tử oxy có 6 electron ở lớp vỏ ngoài cùng và thiếu 2 electron trong khi mỗi nguyên tử hydro có một electron và thiếu một electron. Vì vậy, để đạt được trạng thái ổn định, một nguyên tử oxy sẽ chia sẻ hai electron với hai nguyên tử hydro trong một liên kết cộng hóa trị, và chúng tạo thành một phân tử. Về cơ bản, cả nguyên tử oxy và nguyên tử hydro đều có thêm hai electron bằng cách chia sẻ mỗi nguyên tử một electron.
Đối với carbon dioxide (CO₂), nguyên tử carbon cần thêm bốn electron để ổn định nên sẽ kết hợp với hai nguyên tử oxy để nhận bốn electron (hai electron từ mỗi nguyên tử). Liên kết giữa carbon và oxy mạnh hơn nhiều so với liên kết giữa oxy và hydro trong phân tử nước. Giống như hai bàn tay nắm lấy nhau sẽ chắc hơn một bàn tay, khi số lượng electron mà chúng chia sẻ nhiều hơn thì liên kết của chúng cũng mạnh hơn.
Trong số các nguyên tố, có những nguyên tố thích cho đi một cách hào phóng. Các kim loại như natri, nhôm và sắt tuân theo quy tắc bát phân và dễ dàng giải phóng các electron còn lại. Ngược lại, các phi kim như oxy, nitơ và clo thích nhận electron hơn là cho. Liên kết giữa chúng được gọi là liên kết ion, là liên kết tĩnh điện trong đó kim loại cho electron sẽ trở thành ion mang điện tích dương, còn phi kim nhận các electron đó trở thành ion mang điện tích âm.
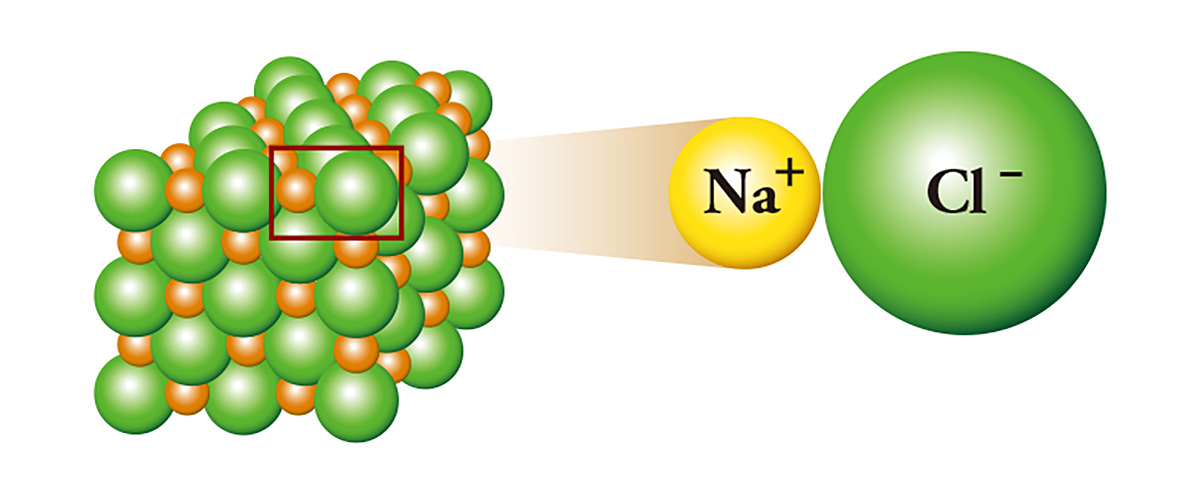
Natri clorua (NaCl), thường được gọi là muối, là một đại diện của liên kết ion; natri có thừa một electron, liên kết với clo bằng cách nhường electron cho clo thiếu một electron. Natri cho electron trở thành ion dương và clo nhận electron trở thành ion âm. Kết quả là, một lực hút tĩnh điện xảy ra giữa hai ion và chúng dính vào nhau giống như hai cực bắc nam của nam châm và tạo ra các tinh thể. Natri là kim loại có phản ứng mạnh đến mức cần được lưu trữ trong dầu khoáng hoặc dầu hỏa, gặp clo là chất độc được sử dụng làm khí độc và trở thành muối.
Liên kết kim loại có thể được nhìn thấy trong các kim loại rắn được tạo thành bởi một loại nguyên tử như vàng hoặc nhôm. Đây là một loại liên kết hóa học được hình thành giữa các nguyên tử mang điện tích dương mà trong đó các electron tự do được chia sẻ trong một mạng lưới các ion dương. Các electron phân chia này chuyển động tự do giữa các ion dương và duy trì sự liên kết. Mặt khác, các nguyên tử đã cho electron trở thành các ion dương và chia sẻ các electron ấy.
Liên kết nguyên tử bằng cách chia sẻ hoặc trao đổi các electron. Đôi khi các chất gây nguy hiểm kết hợp với nhau để tạo thành một hợp chất ổn định hơn bất kỳ hợp chất nào khác và tùy thuộc vào cách chúng kết hợp với nhau mà chúng trở nên yếu đi hoặc mạnh hơn. Trong thế giới của các hạt, các nguyên tử được kết hợp với nhau và tạo thành các hợp chất hoàn toàn khác nhau.
Hầu hết các vật chất chỉ được tạo thành từ khoảng 20 nguyên tố. Tuy nhiên, chỉ một vài nguyên tố này khi kết hợp với nhau lại có thể tạo ra rất nhiều hợp chất khác nhau. Theo Dịch vụ Tóm tắt Hóa chất (CAS) một bộ phận của Hiệp hội hóa chất Hoa Kỳ có hơn 140 triệu chất hóa học trên trái đất và hơn 10.000 hợp chất mới đang được đăng ký mỗi ngày (tính đến tháng 4/2018). Giả sử rằng vẫn còn rất nhiều hợp chất chưa được phát hiện, số lượng các chất hóa học thậm chí sẽ còn lớn hơn nữa. Sự mầu nhiệm thế giới vi mô, nơi đang tạo ra vô số hợp chất, thực sự rất bí ẩn.