
Орчлон ертөнц тэр чигээрээ матери. Эргэн тойрноо хальт харахад л ус, агаар, хад чулуу гээд байгалийн зүйлс, түүнчлэн хуванцар винил гээд хиймэл зүйлс ч бүгд л материас бүтсэн байдаг. Материйг жижиг хэсгүүдэд хуваавал юу болох бол? Цааш задарч хуваагдахгүй болтол нь хуваах юм бол материйн үндсэн нэгж болох атом үлдэнэ.
Нэг төрлийн атомоос тогтсон, бүх юмсыг бүрдүүлдэг цэвэр бодисыг элемент гэж нэрлэдэг. Ойролцоогоор 110 гаруй элемент илэрсэн байдгийн 90 орчим нь байгальд байдаг. Түүнээс гадна ердөө 40 орчим элемент нь л түгээмэл юм.
Химийн нэгдлийн нууц
Нэгэн тоглоомын паркт жижиг жижиг дөрвөлжин өнгөт блокоор барьсан тосгон байдаг. Уран барилгын дурсгал гэгдэх томоохон барилга байгууламж, машин тэрэг, тоглоомын талбай дахь дүүжин савлуурыг ч хүртэл блок өрж барьдаг нь гайхалтай. Үүн шиг бидний эргэн тойронд байдаг бүх бодис хоёр ба түүнээс дээш элементүүдийн нэгдлээс бүрддэг. Хэд хэдэн төрлийн блок давхарлан, янз бүрийн хэлбэр дүрс бий болгодог шиг атомууд нийлж, янз бүрийн бүтэц найрлага бүхий нэгдэл үүсгэнэ.
Сонирхолтой нь найрлагуудын шинж чанар элементүүдийн бүрэлдэхүүн хэсгийн шинж чанараас эрс ялгаатай байдаг байна. Усны молекул (H₂O) нь ус төрөгчийн хоёр атом, хүчилтөрөгчийн нэг атомтой нийлж, үүссэн нэгдэл юм. Гол төлөв хоёр атом нийлж молекул үүсгэдэг устөрөгч (H₂) нь шатамхай хий бөгөөд агаартай шүргэлцэхэд амархан шатдаг бодис юм. Устөрөгчтэй адилхан хоёр атомт молекул болох хүчилтөрөгч (O₂) нь өндөр урвалд ордог тул бараг бүх элементтэй шууд нэгдэнэ. Энэ хоёр бодисын нийлэмж болох ус нь ерөнхийдөө шингэн төлөвтэй, маш тогтвортой. Ус нь хүчилтөрөгч юм уу устөрөгч шиг бусад материалыг шатаах эсвэл өөрөө шатахын оронд гал унтраахад ашиглагддаг байна.
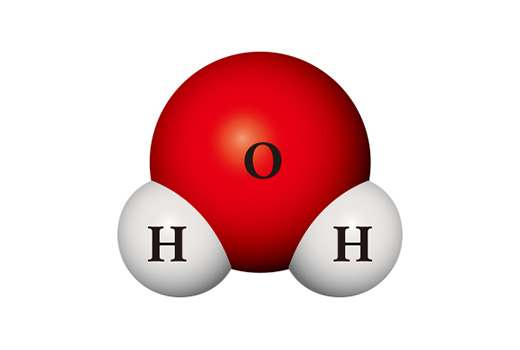
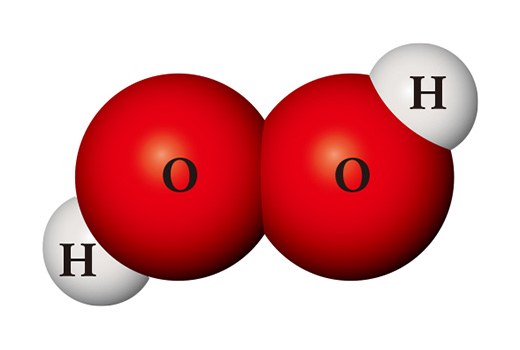
Нэг ижил төрлийн атомоос огт өөр өөр бодис үүсгэж болно. Хэрвээ устөрөгчийн хоёр атом хүчилтөрөгчийн хоёр атомтой нэгдвэл устөрөгчийн хэт исэл (H₂O₂) болж, ариутгалын бодис хэлбэрээр ашиглагдана. Устөрөгчийн хэт исэл нь уснаас ялгаатай нь маш тогтворгүй тул өрөөний температурт ус, хүчилтөрөгч болж амархан задарна.
Яг л ижил хэлбэртэй, ижил хэмжээтэй тоосгоор янз янзын юм хийж болдог шиг зөвхөн нэг төрлийн элементээр янз бүрийн бодис үүсгэж болно. Тэр дундаа нүүрстөрөгч их өвөрмөц ер бусын. Алмааз ч, бал чулуу ч аль аль нь зөвхөн нүүрстөрөгчөөр бий болдог хэрнээ өөр өөр химийн холболтын бүтцээс шалтгаалж огт өөр шинж чанартай байдаг.
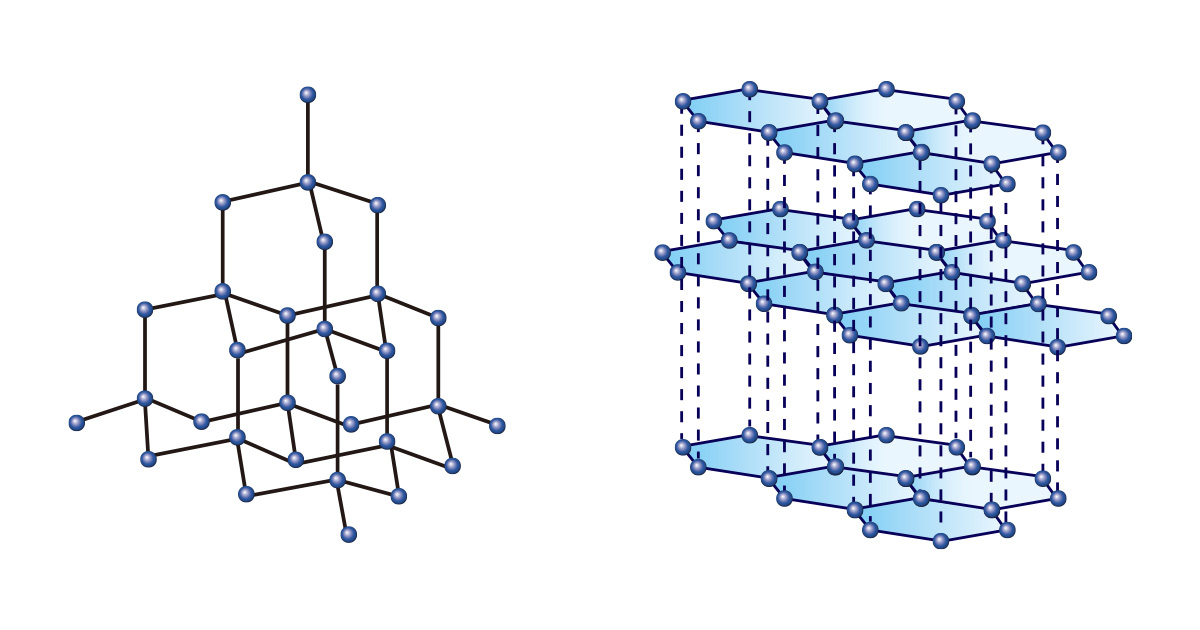
Нүүрстөрөгчийн атом тасралтгүй тетраэдр бүтэцтэйгээр нийлж холбогддог алмааз нь маш хатуу, мөнхийн мөнхийг бэлгэдсэн эрдэнийн чулуу гэж тооцогдоод зогсохгүй аж үйлдвэрийн салбарт материал зүсэх, өнгөлөх зэргээр ашиглагддаг. Харин нөгөөтэйгүүр зургаан өнцөгтийн хоёр хэмжээст бүтэц давхарлаж байрласан бал чулуу нь зөөлөн төдийгүй амархан зурагддаг тул харандаа болгон ашигладаг.

Нэгдэл үүсэх дүрэм
Атомууд нэгдэл үүсгэдэг тодорхой дүрэм журам бий. Атом нь эерэг цэнэгтэй цөм болон түүнийг хүрээлэх электрон гэж нэрлэгдэх нэг буюу хэд хэдэн сөрөг цэнэг бүхий бөөмсөөс бүрдэнэ. Атомын цөм нь протон нейтрон хоёроос бүрдэнэ. Нэг атом дахь протон, электроны тоо адилхан байдаг тул атом өөрөө цахилгааны хувьд саармаг юм.
Электронуудын авч буй энергийн төлвийг энгийнээр ялгахын тулд электронууд атомын цөмийн эргэн тойронд энергийн түвшний дагуу давхраануудтай байдаг гэж эрдэмтэд үздэг. Электроноос үүссэн давхрааг электрон бүрхүүл гэж нэрлэдэг ба бүрхүүл болгонд тодорхой тооны электронууд байдаг байна. Эхний давхраанд нь 2 электрон, хоёрдугаар давхраанд 8 электрон, гуравдугаар давхраанд 18 электрон байж болно.
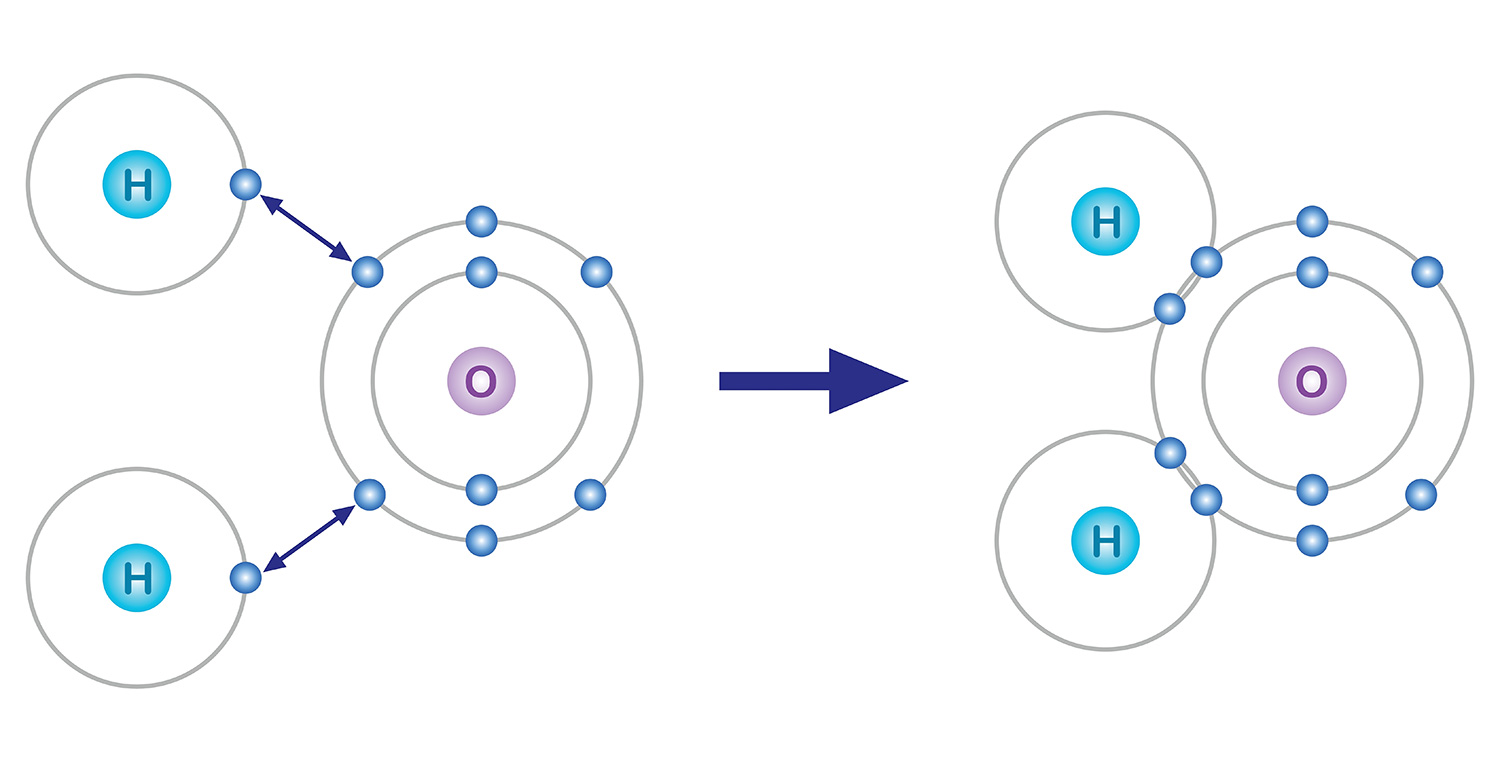
Тэр дундаас захын бүрхүүл дэх электронууд нь химийн холбоонд ордог байна. Атом ер нь электрон алдаж байсан ч, олж байсан ч хамгийн сүүлчийн бүрхүүл дээрээ найман электронтой байх хандлагатай. Үүнийг октет дүрэм гэнэ. Жишээлбэл 8 электронтой хүчилтөрөгч эхний бүрхүүлдээ 2 электрон агуулж, хоёр дахь бүрхүүл дээрээ 6 электрон агуулдаг байна. Тийм учраас сүүлчийн бүрхүүлийн тухайд 8 электронтой байхын тулд химийн холбоо нь 2 электрон нэмж олох үүрэг гүйцэтгэнэ.
Янз бүрийн химийн холбоо
Нэг атом бусад атомуудтай нэгддэг олон янзын арга зам бий. Тэдний нэг нь атомууд гар гараасаа барьж байгаа мэтээр нэг нэгэндээ электрон хуваалцаж, улмаар октет дүрмийг биелүүлдэг ялах-ялах стратегитай ковалент холбоо юм. Атомын нэгдлээр бий болдог бөөмүүдийг молекул гэнэ.
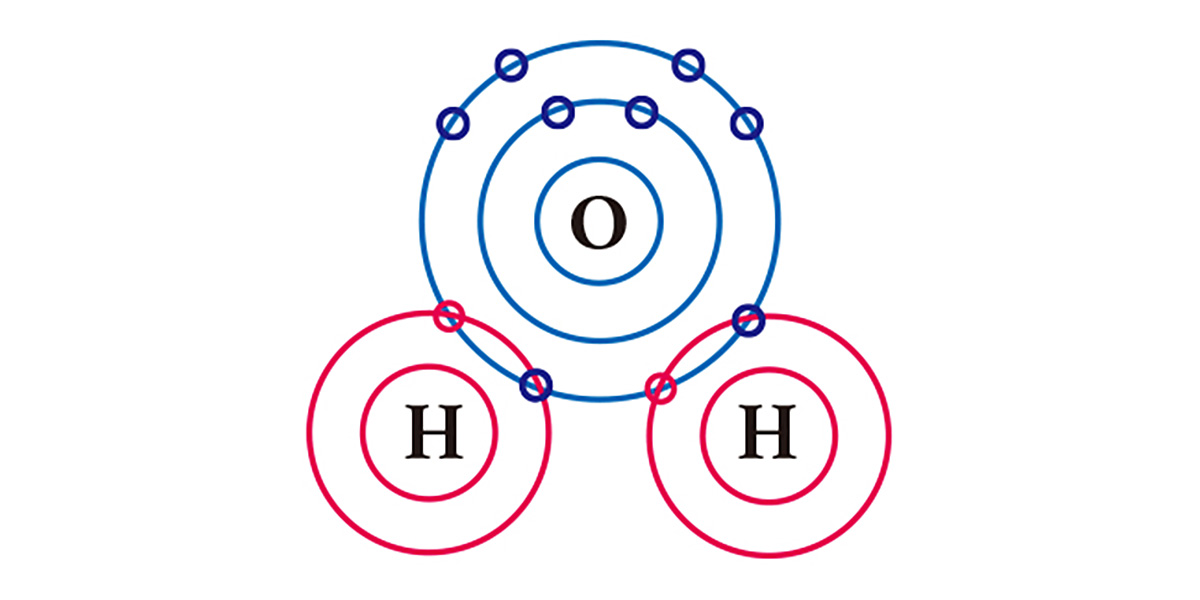
Жишээ болгож усыг авч үзье. Захын электрон бүрхүүл дээрээ 6 электронтой хүчилтөрөгчийн атом нь 2 электрон дутаж, улмаар 1 электронтой устөрөгчийн атом 1 электроноор дутна. Тиймээс электроны тоог тэнцүүлэхийн тулд хүчилтөрөгчийн нэг атом нь ковалент холбоогоор устөрөгчийн хоёр атомын нэг нэг электроныг хуваалцан, улмаар тэд нэг молекул үүсгэнэ. Үндсэндээ хүчилтөрөгчийн атом ч, устөрөгчийн атом ч нэг электрон хуваалцах байдлаар тус тус хоёр электронтой болж байгаа гэсэн үг.
Нүүрстөрөгчийн давхар ислийн (CO₂) хувьд электроны тоог тэнцүүлэх үүднээс нэмэлт 4 электрон шаардлагатай нүүрстөрөгчийн атом нь хүчилтөрөгчийн 2 атомтой нэгдэж, тус тус 2 электроныг хуваалцан, холбогддог. Нүүрстөрөгч болон хүчилтөрөгчийн хоорондын холбоо нь усны молекул дахь хүчилтөрөгч болон устөрөгчийн хоорондын холбооноос илүү хүчтэй байдаг байна. Яг л хөтлөлцсөн хоёр гар нэг гараас хүчтэй байдаг шиг тэдний хоорондоо хуваалцах электроны тоо их байдаг учраас холбоо нь илүү бат бөх байдаг байна.
Элементүүдийн дунд өгөөмрөөр өгөх дуртай элемент бий. Натри, хөнгөн цагаан, төмөр зэрэг металлууд октет дүрэм биелүүлж, үлдсэн электроноо амархан суллаж өгнө. Эсрэгээрээ хүчилтөрөгч, азот, хлор зэрэг металл биш элементүүд электрон өгөх гэхээсээ электрон авахыг илүүд үздэг байна. Тэдгээрийн хоорондын холбоог ионы холбоо гэж нэрлэдэг байна. Энэ бол металл нь эерэг цэнэгтэй катион болохын тулд электроноо алдаж, харин металл бус нь сөрөг цэнэгтэй анион болохын тулд эдгээр электроныг хүлээн авдаг цахилгаан статик холбоо юм.
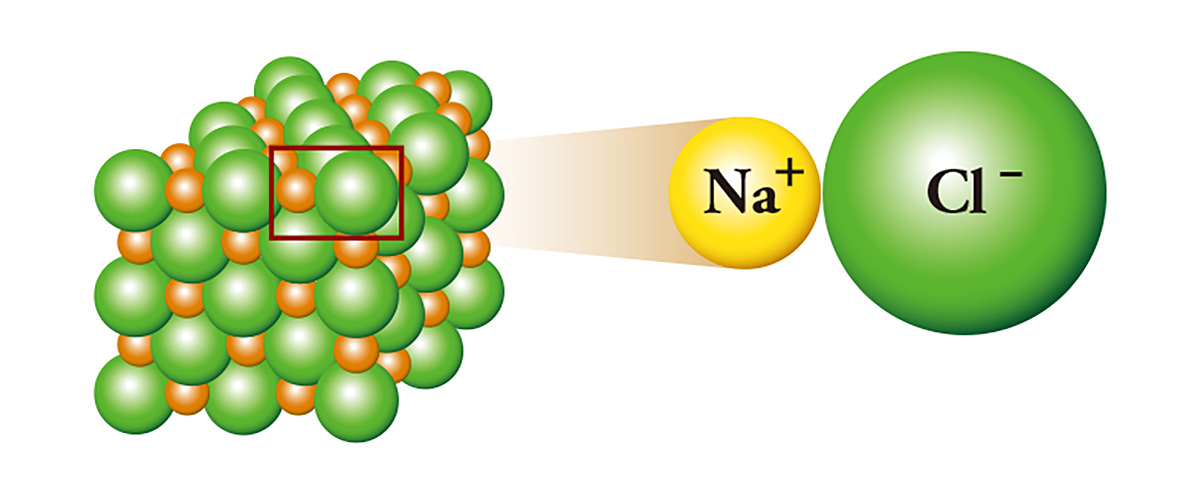
Ерөнхийд нь давс гэж нэрлэдэг натрийн хлорид (NaCl) нь ионы холбооны төлөөлөл. Нэг илүү электронтой натри нэг электроноор дутуу хлорт нэг электроноо өгч, улмаар хлортой нэгдэнэ. Электроноо өгсөн натри катион болж, электрон авсан хлор нь анион болно. Үүний үр дүнд хоёр ионы хооронд цахилгаан соронзон таталцал үүсч, тэдгээр нь соронзны хойд болон өмнөд туйл шиг бие биедээ наалдаж, улмаар талст үүсгэнэ. Ашигт малтмалын тос, керосинд хадгалагдах урвал өндөртэй металл болох натри, хорт хий болгон ашигладаг хлор хоёр нэгдэж, давс болдог байна.
Металл холбоог алт, хөнгөн цагаан мэтийн нэг төрлийн атомоос бүтсэн хатуу металлаас харж болно. Энэ нь эерэг цэнэгтэй атомуудын хооронд бий болсон химийн холбооны нэг төрөл бөгөөд чөлөөт электронууд нь катион үүсгэн, хэрэглээг нь нэмэгдүүлсэн электронууд катионуудын хооронд чөлөөтэй хөдөлж, улмаар холбоогоо хадгалдаг байна.
Атомууд электрон хуваалцаж, солилцох замаар холбогддог. Зарим үед аюултай бодисууд нийлж, өөр бусад нэгдлээсээ илүү тогтвортой нэгдэл үүсгэдэг төдийгүй тэд хэрхэн нийлэхээс шалтгаалж бат бөх, эсвэл сул болно. Бөөмсийн ертөнцөд ийнхүү атомууд харилцан нэгдэж, тэс өөр элемент үүсгэдэг байна.
Ихэнх матери ердөө 20 элементээс л бүрддэг. Харин энэ хэдхэн элемент нь хоорондоо нэгдэх үед олон өөр өөр нэгдэл бий болох боломжтой. Америкийн Химичдийн холбооны (CAS, Chemical Abstracts Service) тооцсоноор дэлхий дээр 140 сая химийн бодис байдаг ба өдөр тутамдаа 10000 шинэ химийн нэгдэл бүртгэгдэж (2018 оны 4-р сарын байдлаар) байдаг байна. Хараахан илрээгүй олон нэгдэл байсаар байгааг тооцвол химийн бодисын тоо бүр ч их байх юм. Тоо томшгүй, үй олон төрлийн нэгдлүүдийг бий болгох бичил ертөнцийн зүй тогтол үнэхээр ер бусын юм.